基本情報
|
2023年06月01日 |
|
| タクザイロ®皮下注300mgシリンジ 電子化された添付文書改訂のお知らせ(「使用上の注意」改訂のお知らせ) | |
|
2023年06月01日 |
|
| タクザイロ®皮下注300mgシリンジ投薬期間制限解除のご案内 |
製品・疾患紹介動画
タクザイロの効能又は効果は、「遺伝性血管性浮腫の急性発作の発症抑制」です。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
急性発作時の投与は認められておりません。
タクザイロの効能又は効果は、「遺伝性血管性浮腫の急性発作の発症抑制」です。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
タクザイロの用法及び用量は電子添文において、以下のように記載されています。
「通常、成人及び12歳以上の小児には、ラナデルマブ(遺伝子組換え)として1回300mgを2週間隔で皮下注射する。なお、継続的に発作が観察されず、症状が安定している場合には、1回300mgを4週間隔で皮下注射することもできる。」
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
タクザイロの禁忌は電子添文において、「本剤の成分に対し過敏症の既往歴のある患者」となっています。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
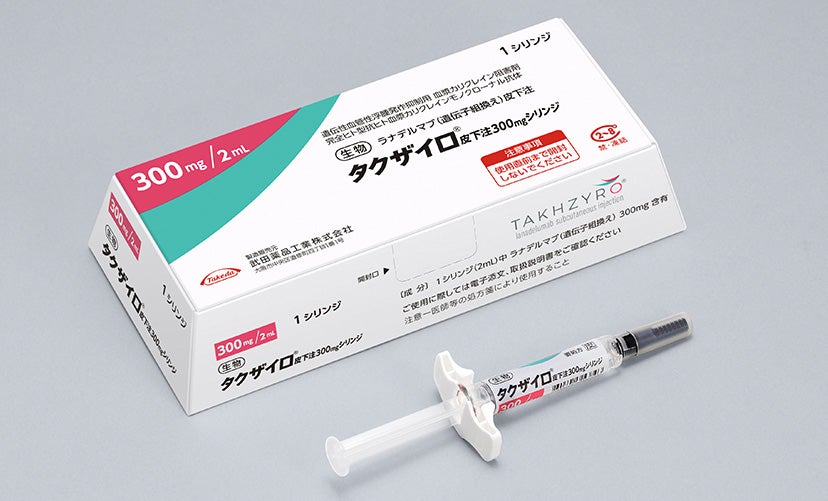
タクザイロの投与部位は、腹部、大腿部又は上腕部で、それぞれ左右に皮下投与することができます。
タクザイロ皮下注はプレフィルドシリンジ製剤なので、調製の必要はありません。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
患者指導用資材として下記の資材を準備しております。
■自己投与の手順書「自己注射ガイドブック—タクザイロ®皮下注300mgシリンジをご自身で注射される方へ」
患者さん、患者さんのご家族にタクザイロの自己投与を正しく安全に実施していただくために、自己投与の手順や注意するポイントについてわかりやすく紹介した冊子です。
閲覧、ダウンロードはこちらから
■自己投与の説明用動画「タクザイロ®皮下注300mgシリンジをご自身で注射される方へ—自己注射の解説」
患者さん、患者さんのご家族にタクザイロの自己投与を正しく安全に実施していただくために、自己投与の手順や注意するポイントについてわかりやすく紹介した動画です。
閲覧はこちらから
タクザイロの自己投与は、患者さんに十分な教育訓練を行い、注射による危険性と対処法について理解していただいた上で、医師の管理指導のもとで実施してください。
なお、電子添文には以下のように記載されています。
8.重要な基本的注意(抜粋)
8.2.1
自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施したのち、本剤投与による危険性と対処法について患者又はその家族が理解し、患者又はその家族が確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、適用後、本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。
8.2.2
自己投与を適用する場合には、使用済みの注射針及び注射器を再使用しないように患者又はその家族に注意を促し、全ての器具の安全な廃棄方法に関する指導を行うと同時に、使用済みの注射針及び注射器を廃棄する容器を提供すること。
患者指導用資材
自己投与の手順書や動画を準備しております。
閲覧、ダウンロードはこちらから
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
注射部位反応を始め有害事象が現れる場合があります。タクザイロの投与後に副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行ってください。
注射部位反応として認められる症状
臨床試験において認められた注射部位反応は、疼痛、紅斑、内出血、不快感、血腫、出血、そう痒感、腫脹、硬結、異常感覚、反応、熱感、浮腫、発疹でした。
国内第Ⅲ相臨床試験における安全性
12例中8例(66.7%)に副作用が認められました。主な副作用は、注射部位反応6例(50.0%)でした。
海外第Ⅲ相臨床試験における安全性(外国人のデータ)
タクザイロ300mgを2週に1回投与した27例中26例(96.3%)に副作用が認められました。主な副作用は、注射部位疼痛(51.9%)、ウイルス性上気道感染(37.0%)及び頭痛(33.3%)でした。
タクザイロ300mgを4週に1回投与した29例中25例(86.2%)に副作用が認められました。主な副作用(20%以上)は、注射部位疼痛(31.0%)及びウイルス性上気道感染(24.1%)でした。
注射後に起きた異常や体調の変化などを患者さん自身で記録していただくように、下記の資材を準備しております。
●治療日誌
タクザイロを注射した日にち・部位・注射後の症状、発作・体調の変化などを、患者さん自身で記録するための冊子です。
閲覧、ダウンロードはこちらから
●スマホアプリ
ダウンロードはこちらから
十分な教育訓練を受けていれば、ご家族でも注射を打つことが可能です。その際には、本剤投与による危険性と対処法についてご家族が理解し、医師が確実に投与できることを確認する必要があります。
患者指導用資材
自己投与の手順書や動画を準備しております。
閲覧、ダウンロードはこちらから
注射時の痛みが和らぐとされている方法はいろいろありますが、感じ方は人によって異なります。以下を参考に、患者さんご自身に合う方法を探してください。
<痛みが出にくい注射のしかた>
●針を刺す数秒前から注射する部位を圧迫し、しっかりつまみながら注射する
●消毒用アルコールがしっかり乾いてから針を刺す
●針は1回でスーッと刺す
●注入後は針を素早く抜く
<痛みを出にくくする方法>
●注射前に注射する部位を保冷剤などで冷やしておく
●注射前に皮膚をさすったり、マッサージしたりしておく
●注射前に深呼吸をするなど、できるだけリラックスしておく
患者指導用資材
自己投与の手順書や動画を準備しております。
閲覧、ダウンロードはこちらから
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
また、授乳婦の方の場合、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。動物実験(サル)で本剤の乳汁移行が認められています。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
タクザイロの小児への使用は推奨されておりません。
低出生体重児、新生児、乳児、幼児又は12歳未満の小児を対象とした国内臨床試験は実施していません。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
投与前に、内容物を目視により確認してください。異物又は変色が認められる場合は、使用しないでください。
また、投与の際は腹部、大腿部又は上腕部に、1回の投与でシリンジ内の全量を皮下投与してください。本剤は1回で全量を使用する製剤のため、再使用しないでください。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
重大な副作用としてアナフィラキシー(頻度不明)が報告されています。
主な副作用は、以下のとおりです。
10%以上に発現したもの
注射部位反応(疼痛、紅斑、内出血、不快感等)
5~10%未満に発現したもの
浮動性めまい
1~5%未満に発現したもの
そう痒症、不快感、舌のピリピリ感、ALT増加、AST増加、筋肉痛、斑状丘疹状皮疹
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
タクザイロの有効成分であるラナデルマブは、活性化された血漿カリクレイン(pKal)の基質切断活性に対する特異的な阻害薬であり、複数の海外第Ⅲ相臨床試験や、国内第Ⅲ相臨床試験から有効性が認められています。
詳細は臨床試験ページをご確認ください。
ラナデルマブが欧米で承認されて以降、国際的なガイドラインや米国、カナダのガイドライン1,2,3)において、ラナデルマブはC1-INHとともに長期予防の第一選択薬として推奨されています。
(参考資料)
- Maurer M, et al. Allergy. 2022; 77(7): 1961-1990.
- Busse PJ, et al. J Allergy Clin Immunol Pract. 2021; 9(1): 132-150.
- Bestschel S, et al. Allergy Asthma Clin Immunol. 2019; 15: 72.
pKal活性を制御できないため、過剰となったブラジキニンが内皮細胞及び平滑筋細胞表面のブラジキニンB2受容体へ結合することにより血管性浮腫が発現します。
ラナデルマブは活性化されたpKalの基質切断活性に対する特異的な阻害薬であり、遺伝性血管性浮腫(HAE)の急性発作の原因となるブラジキニンの過剰な放出を抑制します。
詳細は作用機序ページをご確認ください。
タクザイロは、pKalの基質切断活性に対する特異的な阻害薬です。
HAEは、C1-INHの欠損又は機能障害によるブラジキニンの過剰産生に起因し、ブラジキニンは、HAEの主要症状である局所の腫脹、炎症及び疼痛の原因と考えられる血管拡張作用を有します。
タクザイロは、ブラジキニンの過剰な放出を抑制し、その結果、HAEの発作抑制作用を示します。
海外臨床試験において、本剤投与群220例中10例(4.5%)で基準値上限の1.5倍を上回る活性化部分トロンボプラスチン時間(aPTT)の延長が認められました。
(参考資料)
タクザイロ皮下注300mgシリンジ 電子添文
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。