アジレクト錠1mg・0.5mg 発売中
パーキンソン病診療のClinical Questionパーキンソン病の睡眠障害を考える


1 パーキンソン病患者さんにみられる睡眠障害の特徴について教えてください。
概要(病態・疫学・分類)
睡眠障害はパーキンソン病(PD)でみられる主要な非運動症状の一つです。40~90%のPD患者さんで合併すると報告されており1)、訴えが多い症状は中途覚醒と早朝覚醒です2)。
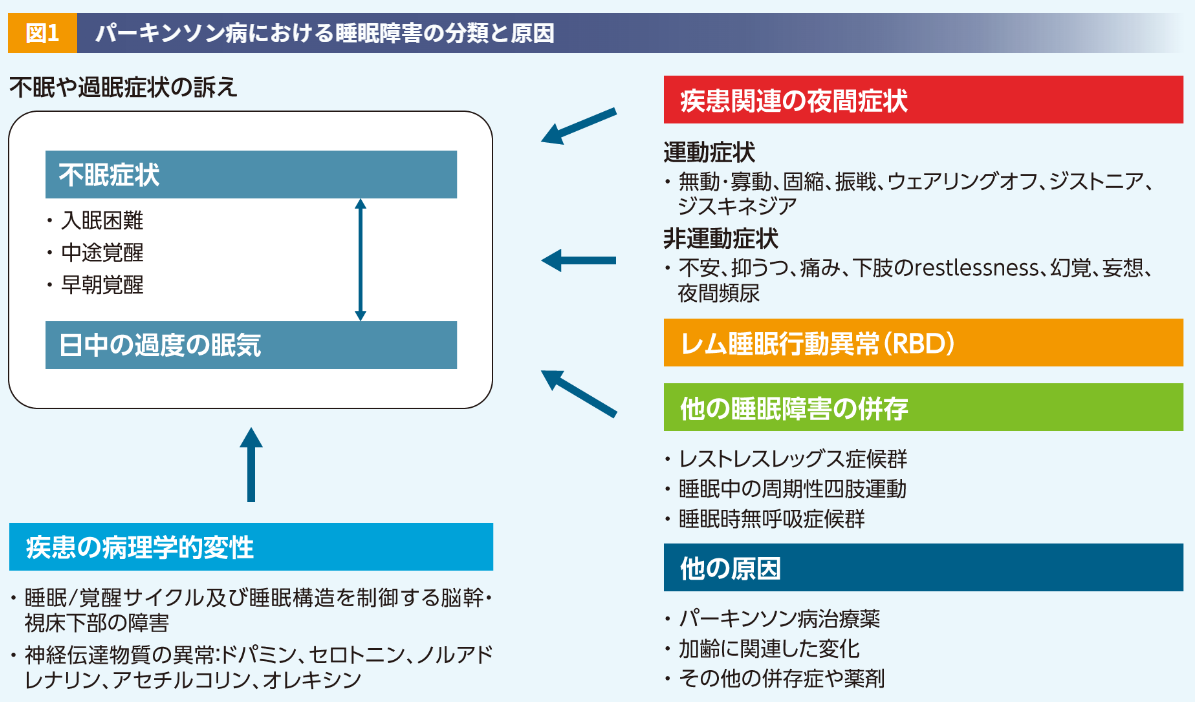
睡眠障害には、夜間の不眠症状、日中の過度の眠気(EDS:Excessive Daytime Sleepiness)、突発的睡眠、レム睡眠行動障害(RBD:REM Sleep Behavior Disorder)などがあります(図1)3)。このうち、夜間の不眠症状は、なかなか寝付けない入眠困難、夜中に目覚めて再入眠ができない中途覚醒、そして予定より早く目覚めてしまう早朝覚醒の3つに分けられ、PD患者さんでは、中途覚醒と早朝覚醒が多くみられます。夜間の不眠症状は、それ自体で困るだけでなく、EDSの原因にもなります。逆に、EDSによって昼寝をしすぎてしまうことで夜間の不眠症状につながり、悪循環を引き起こします。なお、EDSには夜間の不眠症状とは独立してみられるタイプもあります。
EDSと突発性睡眠には関連があることが示されています4)。わが国の188例のPD患者を対象とした多施設研究で、EDSがある(Epworth Sleepiness Scale、ESS≧10)群では22.5%に突発的睡眠がみられたのに対して、EDSがない(ESS<10)群では2.0%のみで、ESSスコア10点以上は感度75%、特異度82.4%で突発的睡眠を予測しました。しかし眠気の強くない場合でも突発的睡眠をきたしうることに注意が必要です。ロジスティック回帰分析による突発的睡眠の予測因子はESS、UPDRS Part Ⅰ、L-ドパ換算用量相当量(LEDD:levodopa equivalent daily dose)でした※1。
※1 ESS:p=0.011、LEDD:p=0.025、UPDRS Part Ⅰ:p=0.043(年齢、性別、罹病期間、ESS、ZungのSDS(Self-rating Depression Scale)、Hoehn & Yahrステージ、UPDRS Part Ⅰ、Ⅱ、Ⅲ、及びⅣ、並びにLEDDを用いて突発的睡眠を予測)
Suzuki K. J Parkinsons Dis. 2021; 11(3): 971-992.
Suzuki K. J Parkinsons Dis. 2021; 11(3): 971-992.
リスク因子
PDの睡眠障害にはさまざまなリスク因子が知られています。ADL(Activities of Daily Living)や抑うつに関する指標が睡眠障害のリスク因子となることが示されており、運動症状に加えてこれらの改善も目指した総合的な治療が必要と考えます。
PDでは運動症状が発現する前から嗅覚障害や便秘などの症状が発現することがありますが、睡眠障害についてもRBDなどが前駆症状としてみられることがあります。PDの非運動症状のリスク因子を検討した前向き縦断的研究のレビューによると、夜間の不眠症状のリスク因子には、抑うつ、長期の罹病期間、女性、ドパミンアゴニスト使用や認知機能障害が挙げられており、また、EDSのリスク因子には、男性、ドパミンアゴニスト使用、不眠、日常生活動作の障害、認知機能障害や抑うつが挙げられています5)。
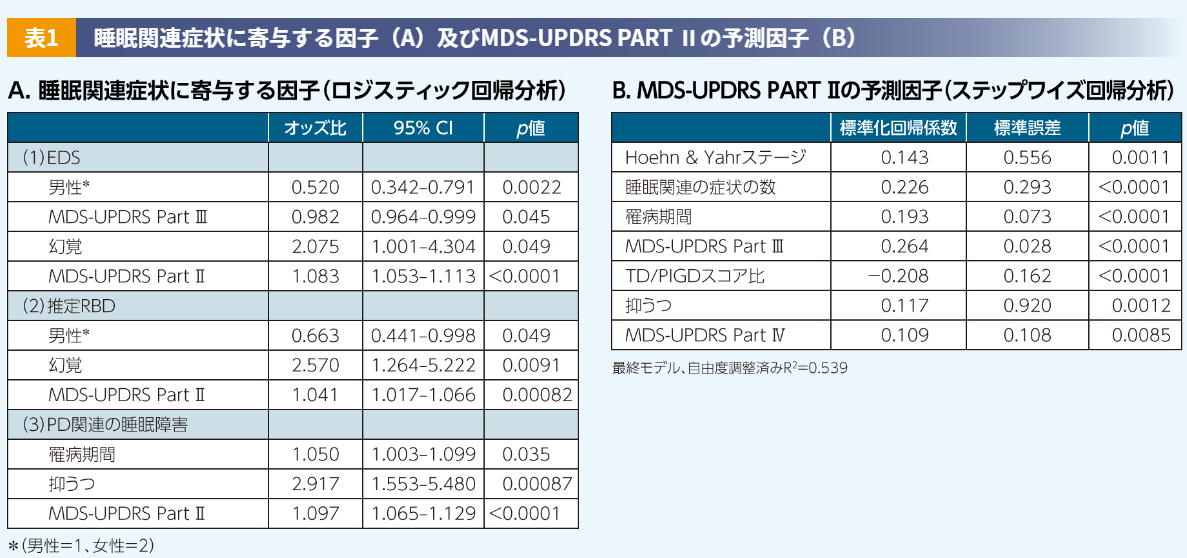
また、わが国のPD患者さん436人及び健康人対照401人を対象として実施した横断研究では、PDの症状のうち日常生活動作(Motor Experiences of Daily Living)に関する側面の評価スコアであるMDS-UPDRS part Ⅱが、各種の睡眠関連症状(EDS、RBD、PDに関連した睡眠障害)に寄与する因子であることが示されています(表1A)6)。さらに、同研究では、このMDS-UPDRS Part Ⅱの予測因子として、Hoehn & Yahrステージ、睡眠関連症状の数、罹病期間、MDS-UPDRS Part Ⅲ、抑うつなどが示されていることから(表1B)、PDの睡眠障害の治療では、疾患由来の運動症状に加えて、MDS-UPDRS Part Ⅱ(日常生活動作)、そしてMDS-UPDRS Part Ⅰ(非運動症状)の抑うつ関連の項目についても改善させることを念頭に置いた総合的な治療が必要と考えます。
【対象・方法】
わが国のPD患者436人及び健康人対照401人を対象として横断研究を実施した。
【解析計画】
EDS、PD関連の睡眠障害、又は推定RBDを従属変数とし、年齢、性別、罹病期間、Hoehn & Yahrステージ、MDS-UPDRS Part Ⅱ、Ⅲ、及びⅣ、視覚的幻覚、過去1年間の転倒、抑うつ、ドパミンアゴニストの使用、並びにレボドパの使用を独立変数としてロジスティック回帰分析を実施した。MDS-UPDRS Part Ⅱの予測因子を検討するために、年齢、性別、Hoehn & Yahrステージ、罹病期間、MMSE(Mini Mental State Examination)、MDS-UPDRS Part Ⅲ及びⅣ、睡眠関連の症状の数(0~3;PDSS-2、推定RBD又はEDS)、抑うつ、振戦優位(TD:Tremor Dominant)/姿勢反射障害・歩行障害(PIGD:Postural Instability and Gait Disturbances)スコア比、ドパミンアゴニストの使用、及びレボドパの使用を独立変数として、ステップワイズ回帰分析を行った。両側p<0.05である場合に統計学的に有意であるとみなした。
【リミテーション】
本研究では睡眠ポリグラフ検査を行っていない。本研究におけるRLSの発現率は既報のものよりも低く、他の睡眠関連症状よりも睡眠障害への影響が小さくなっており、患者のRLSの重症度の分布範囲が結果に影響を及ぼした可能性がある。また、本研究では、PD関連の睡眠障害、RBD、EDSに影響を与える可能性のある軽度認知障害や衝動制御障害の患者が評価されておらず、またドパミンアゴニストの種類の影響についても評価されていない。
Suzuki K, et al. J Neurol Neurosurg Psychiatry. 2017; 88(11): 953-959(改変)
原因
PDの睡眠障害にはさまざまな原因があり、原因の違いに応じて発現する症状の種類も異なります。
不眠症状の原因としては、PD自体の病理である神経変性(ドパミン神経系、セロトニン神経系、ノルアドレナリン神経系、及びアセチルコリン神経系の睡眠・覚醒に関与する部位の変性)、PDの運動症状や非運動症状のほか、レム睡眠行動異常症、周期性四肢運動障害、レストレスレッグス症候群(RLS:Restless Legs Syndrome)、睡眠時無呼吸症候群(SAS:Sleep Apnea Syndrome)、薬剤の影響などが挙げられます。メラトニンについては、メラトニン濃度の時間依存性の変動について、健康人対照では有意な日内変動がみられた※2のに対して、PD患者さんでは健康人対照に比べてメラトニン血漿中濃度のAUC及び最低値の減少がみられた※3という報告があります7)。
PD患者さんでは中途覚醒及び早朝覚醒が多くみられるのですが、これはPDの運動及び非運動症状が原因と考えます。運動症状については、英国のPD患者220例を対象とした調査で患者さんが経験した夜間の症状のうち最も多かった運動症状は「寝返り困難」であり8)、そのために覚醒してしまうと考えます。また、非運動症状については、精神症状、不安、抑うつ、痛みなどが睡眠に影響を与えます。精神症状というのは、例えば、幻覚で見えている猫や人を追い払おうとして寝ることができないといったものです。抑うつについては主に入眠困難の原因となると考えますが、逆に睡眠障害が抑うつの原因になることも考えられます。睡眠障害の重症度と抑うつの関連については、点数が高いほど抑うつ症状が重いことを示すSDSスコアと点数が低いほど夜間の睡眠障害が重いことを示すPDSS(Parkinson's Disease Sleep Scale)合計スコアとの間に負の相関が示されています(図2)9)。
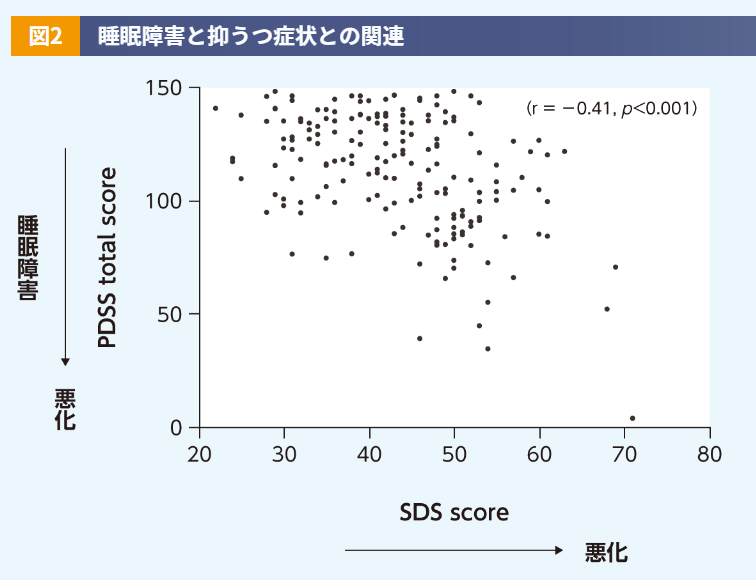
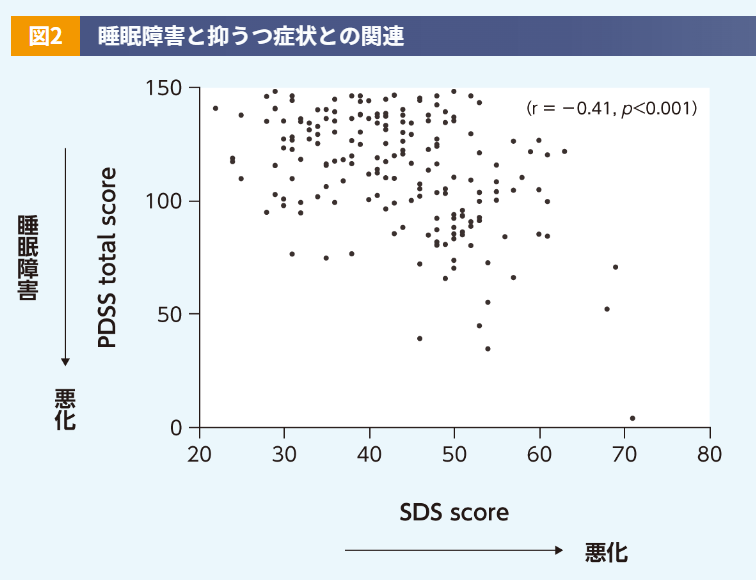
【対象・方法】
日本のPD患者188人及び年齢を一致させた健康人対照144人を対象として多施設横断研究を実施し、睡眠障害の指標であるPDSSスコアと抑うつ症状の指標であるZungのSDSスコアについて評価した。
【解析計画】
PD患者におけるSDSとPDSSの相関を検討するために、Spearmanの相関係数を算出した。
【リミテーション】
SDSにおける疲労、睡眠障害、便秘などの項目はPD自体の症状に基づくことがあり、日常生活や仕事に関連する項目は運動機能の障害の影響を受けることがある。また、SDSは被験者自身の自己評価に基づく評価ツールであるため、PDではうつ病を過大評価する傾向がある。
Suzuki K, et al. Parkinsonism Relat Disord. 2009; 15(1): 15-19.
鈴木圭輔ほか. 難病と在宅ケア. 2015; 21(5): 21-25.
このように、抑うつと睡眠障害には密接なかかわりがあることから、PD患者さんの睡眠障害を改善することにより、抑うつ症状も改善できる可能性が十分あります。なお、この研究で使用しているPDSSは改訂前のものであり、点数が高いほど睡眠障害が重いことを示す最新のPDSS-2とは睡眠障害とスコアの関係が逆になっていることにご注意ください。薬剤の影響については、わが国のPD患者188例を対象とした研究において、麦角系ドパミンアゴニスト服用患者さんと非麦角系ドパミンアゴニスト服用患者さんの間でESSスコアに差がなかったという報告があります4)。
※2 F16,176=1.873、p=0.03 二元配置反復測定分散分析(年齢及び性別で調整)
※3 AUC:β=−0.341、p=0.048 最低値:β=−0.461、p=0.004 共に、二元配置反復測定分散分析(年齢及び性別で調整)
治療
PD患者さんの睡眠障害の治療では、問診によってその原因を明らかにすることが重要です。
高齢の方は睡眠が浅く中途覚醒が起こりやすいのですが、PD患者さんの場合は夜間から早朝にかけてのオフ症状、例えば寝返り困難などの運動症状によって、さらに中途覚醒が起こりやすくなります。また、主に中途覚醒の原因となる非運動症状の痛みについても、夜間から早朝にかけてのオフの運動症状が関係している場合があります。問診によってこのようなオフ症状が確認された場合は、睡眠薬を投与するよりも、PD治療薬によって夜間から早朝にかけてのオフ症状を治療することが先決と考えます。
それから、主に入眠困難の原因となる非運動症状の抑うつについては、ドパミンを補充することでも良い影響が期待でき、その結果として入眠困難への影響も期待できると考えます。
2 睡眠障害がQOLに与える影響について教えてください。
PDの睡眠障害は、患者さんの生活の質(QOL:Quality of Life)に悪影響を及ぼすことが報告されています。早朝のオフ(EMO:Early Morning Off)は睡眠障害の影響を介してQOLに影響を与えることが示されており、症状を早く発見して治療することで、患者さんのQOL低下を抑制することが重要です。
中国上海のPD患者1,006例を対象として実施された多施設共同観察研究では、夜間の症状、EDS、RBD、RLSといった睡眠障害の数が増加するに従ってQOLの指標であるPDQ-39スコアが増加する(QOLが低下する)ことが示されています(図3A)10)。また、睡眠障害が運動合併症を介してQOLに与える影響(間接効果)及びそれを除いた睡眠障害がQOLに与える影響(直接効果)がともに有意であったため※4、睡眠障害は直接的にも、間接的にもQOLに影響を与えていることが示唆されています(図3B)10)。
同じグループが中国上海のPD患者454例を対象として実施した多施設共同観察研究では、PDQ-39スコアは、EMOが発現していた患者(179例)では、発現していない患者(275例)よりも有意に高いことが示され※5、さらに、その要因として、EMOが直接QOLに与える影響に加え、EMOが睡眠障害の影響を介してQOLに与える間接的な影響も存在することが示されました11)※6。なお、本研究ではEMOの発現率は全患者では39.43%、Hoehn & Yahr分類のステージ1〜2では28.14%、ステージ2.5〜3では46.03%、ステージ4〜5では79.41%でした。EMOの発現率については欧州のPD患者320例を対象とした多施設観察研究からの報告もあり、全患者では59.7%、早期の患者では44.3%でした12,13)。いずれの報告においても、部分的に睡眠障害とも関連しながらQOLを低下させる原因となるEMOがかなりの割合のPD患者さんにおいて発現しており、その治療は重要だと考えます。
しかし、睡眠障害などの非運動症状は、QOLに影響を与え、治療により改善が期待できるにもかかわらず見逃されがちです。欧州のPD患者242例を対象とした多施設国際共同研究では、患者さんが申告しないことが多い非運動症状として妄想(未申告:65.2%)、EDS(52.4%)、鮮明な夢(52.4%)などが報告されています14)。
![ALC_睡眠障害の種類の増加とPDQ-39スコアの関係 [海外データ]](/sites/default/files/2024-06/ALC_%E7%9D%A1%E7%9C%A0%E9%9A%9C%E5%AE%B3%E3%81%AE%E7%A8%AE%E9%A1%9E%E3%81%AE%E5%A2%97%E5%8A%A0%E3%81%A8PDQ-39%E3%82%B9%E3%82%B3%E3%82%A2%E3%81%AE%E9%96%A2%E4%BF%82%20%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD.png)
![ALC_睡眠障害の種類の増加とPDQ-39スコアの関係 [海外データ]](/sites/default/files/2024-06/ALC_%E7%9D%A1%E7%9C%A0%E9%9A%9C%E5%AE%B3%E3%81%AE%E7%A8%AE%E9%A1%9E%E3%81%AE%E5%A2%97%E5%8A%A0%E3%81%A8PDQ-39%E3%82%B9%E3%82%B3%E3%82%A2%E3%81%AE%E9%96%A2%E4%BF%82%20%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD_0.png)
【対象・方法】
中国上海のPD患者1,006例を対象として横断的多施設共同観察研究を実施し、夜間の症状、EDS、RBD、RLSといった睡眠障害の数とPDQ-39スコアの関係について検討した。
【解析計画】
睡眠障害の数の増加に応じた臨床的特徴の線形傾向は、連続変数に対しては線形回帰分析、比例変数に対してはロジスティック回帰分析を用いて検定した。多変量調整モデルを使用して、運動合併症と睡眠障害の数に関連するQOLについて、偏回帰係数(βs)と95%CIを算出した。線形回帰モデルは、性別、年齢、罹病期間、PDの重症度、及びドパミンアゴニスト療法について調整した。モデルに睡眠障害の数(0〜4)を連続変数として入力することにより、線形傾向を検定した。
媒介分析により運動合併症の重症度が複数の併存する睡眠障害とPDQ-39との関連を媒介するかどうか検討した。5,000サンプルのブートストラップ推定アプローチを使用して95%CIの間接効果を求め、95%CIにゼロが含まれていない場合に間接効果は有意であるとみなした。p<0.05である場合に統計学的有意性があると設定した。
【リミテーション】
本研究は横断研究であり、発病前又は新規のPD患者は含まれていないため、複数の併存する睡眠障害、運動合併症、及びQOLの間の因果関係は確認できない。また、研究及び日常診療のために開発された睡眠障害スクリーニングツールの種類は増加しており、異なるコホート間の相互比較は、用いるスクリーニングツールの種類によって制限されがちである。最後に、運動合併症の評価に用いられた尺度はUPDRS Part Ⅳのみであり、ウェアリングオフやジスキネジアの尺度は用いられなかったため、患者の運動合併症の詳細な特徴は明らかにできなかった。
Zhang Y, et al. NPJ Parkinsons Dis. 2020; 6: 25.
このように、睡眠障害は運動症状と比較して医師から問診されない限り患者さん自身が訴えることは少なく、また疾患の説明において特別に強調されることも少ないため、患者さん自身がPDの症状として認識していないことが多く、医師からも、患者さん自身からも、そしてそのご家族からも見逃されがちです。PD発症前から不眠症状が発現していた場合、他科を受診して睡眠薬を処方され、その効果を実感できないまま不眠症状をPDと結び付けられずにいる可能性もあります。
睡眠障害のある患者さんの半数以上が朝起きたときに動きが悪いことを訴えている印象で、これらの患者さんについては夜間から早朝にかけてのオフ症状が原因となっていると考えます。そういった患者さんの睡眠障害はいくつかの他の非運動症状と同様にドパミンを補充することで治療可能であり、できるだけ早く発見して治療することで患者さんのQOLの低下を抑制することが重要と考えます。
※4 媒介分析、間接効果:β=0.355、95% boot CI:0.134–0.652、p<0.001 直接効果:β=3.996、95% boot CI:3.001–4.991、p<0.001
※5 p<0.001、Student’s t-検定
※6 媒介分析、間接効果:β=13.458、95% boot CI:6.436–22.042、p<0.001 直接効果:β=24.836、p<0.001
3 睡眠障害を捉える問診票PD Sleep Scale-2(PDSS-2)について教えてください。
PD Sleep Scale-2(PDSS-2)は、PDに関連する夜間症状に注目して作成された15項目からなる問診票です15)。
2011年にPDSSの改訂版となるPDSS-2が公表され、各夜間症状は「とても多い(週6~7日)」、「多い(週4~5日)」、「ときどき(週2~3日)」、「ほとんどない(週1日)」、「全くない」の5段階に評価されます。総得点は0~60点であり、高いほど睡眠障害が重度であることを示します。PDSS-2日本語版の妥当性は検証されており、カットオフ値としてpoor sleeperの検出にはPDSS-2総得点≧15点、臨床的に問題となる睡眠障害の検出にはPDSS-2総得点≧18点が有用であると報告されています15,16)。
図4に当施設で使用しているPDSS-2を軸とした睡眠障害のスクリーニングフローチャートを示します17)。睡眠障害を発見するためには日中の眠気と夜間の不眠症状の両方をチェックする必要があるため、日中の眠気についてはESS、夜間の不眠症状及び夜間のさまざまな症状についてはPDSS-2を用いたスクリーニングを行っています(図4最上部)。PDSS-2で質問される各夜間症状を図4の表中に簡潔に記載しました。この表中の項目1~3は夜間の不眠症状に関する質問であり、項目4以降はPDの症状を表しています。
そのため、項目4以降にも該当するものがあれば、PDに関連する睡眠障害の可能性があります。
項目1~3に加えて項目4、5が高得点であった場合はRLS、RLSの診断基準を満たさないLMR(Leg Motor Restlessness)、感覚運動症状、又は夜間のウェアリングオフによる感覚運動症状と考えRLSのスクリーニングを行います。項目6、7が高得点であった場合はRBDと精神症状の鑑別を行います。RBDと精神症状は併存する場合もあります。項目8の夜間頻尿が該当する場合は、前立腺肥大や過活動性膀胱との鑑別が必要です。項目15が高得点であった場合はSASのスクリーニングを行います。項目9~13は主に夜間の運動症状であり、ウェアリングオフ関連症状であればドパミンの補充により症状の改善が期待できます。

監修:獨協医科大学 脳神経内科 主任教授 鈴木 圭輔 先生

監修:獨協医科大学 脳神経内科 主任教授 鈴木 圭輔 先生
当施設では、受付担当者や看護師に協力を依頼して、初診時及び数回受診されるごとに受付時にPDSS-2のチェックシートを患者さんにお渡しして待合室で記入していただくようにしています。認知症のある患者さん及びかなり症状の進行した患者さんにはチェックシートの記入は難しく、また65歳未満の比較的若くてまだ十分に活動できている患者さんについては省く場合もありますが、ほとんどの患者さんにチェックシートの記入をお願いしています。
診察の待ち時間にPDSS-2の記入を依頼することが難しい施設では、「寝付くまでに30分以上かかるかどうか」と「夜中に何度も起きてその後眠れないかどうか」を質問して、このような症状がある場合は不眠を疑ってみるとよいと考えます。
また、ご家族と一緒に来院された場合には、ご家族にも日中の居眠りについてお伺いするようにしています。患者さんご本人に自覚はなくても、ご家族が患者さんの居眠りを目撃されていることがあるためです。これは、日常的に眠気があって突発的睡眠がしばしば発症していると、患者さんにはその状況が当たり前になり自覚がなくなるためではないかと考えられます。
その他、概日リズム障害、とくに睡眠相後退がある患者さんには衝動制御障害の鑑別が重要です。衝動制御障害により、インターネット閲覧などが深夜に及ぶと概日リズム障害を引き起こし、就寝時刻が深夜になってしまいます。また衝動制御障害があるとRLSを合併しやすく、その結果として睡眠障害に陥ることもあります。
4 夜間症状と日中の眠気に対する治療のポイントについて教えてください。
睡眠障害の訴えがある場合は、前述のPDSS-2などを用いて「症状の原因」を探り、睡眠衛生指導とともに適切な薬物治療を行うことが重要です。
睡眠衛生指導のポイントは、起床時刻を揃えることです。不眠があると就寝時間を揃えることは困難ですが、眠くても決まった時刻に起床し、日の光を浴びて概日リズムを整えることが重要です。また、規則的な運動が睡眠障害の改善に有効であるという報告もあります18)。しかし、就寝前の激しい運動は覚醒を促すので、運動は夕方までくらいに行うとよいと考えます。その他には、暗く静かな寝室環境の整備や、就寝前のテレビや読書を控えること、床上時間が長すぎる場合の制限、昼寝の制限などを指導しています。
睡眠障害の原因となる夜間の症状はさまざまですが(表2)、進行期ではなく早期の患者さんの場合でも、朝の服薬前に体の動きが悪い、ベッドから起きられない、震える、着替えるときにボタンの付け外しが難しい、夜間にRLSがある、寝返りが困難であるといった夜間から早朝にかけてのオフ症状が発現していることがあります。しかし、患者さんの申告は日中の活動の関することが中心ですから、これらの症状については医師の方から積極的に問診で尋ねる必要があります。
![ALC_パーキンソン病でみられる夜間の症状[海外データ]](/sites/default/files/2024-06/ALC_%E3%83%91%E3%83%BC%E3%82%AD%E3%83%B3%E3%82%BD%E3%83%B3%E7%97%85%E3%81%A7%E3%81%BF%E3%82%89%E3%82%8C%E3%82%8B%E5%A4%9C%E9%96%93%E3%81%AE%E7%97%87%E7%8A%B6%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD123.png)
![ALC_パーキンソン病でみられる夜間の症状[海外データ]](/sites/default/files/2024-06/ALC_%E3%83%91%E3%83%BC%E3%82%AD%E3%83%B3%E3%82%BD%E3%83%B3%E7%97%85%E3%81%A7%E3%81%BF%E3%82%89%E3%82%8C%E3%82%8B%E5%A4%9C%E9%96%93%E3%81%AE%E7%97%87%E7%8A%B6%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD123_0.png)
【対象・方法】
1987年3月に英国のPD患者250例を対象として構造化面接を実施し、特発性PD以外の疾患である可能性がある患者を除外した220例の回答について検討した。
【リミテーション】 記載なし
鈴木圭輔ほか. 難病と在宅ケア. 2015; 21(5): 21-25.
Lees AJ, et al. Clin Neuropharmacol. 1988; 11(6): 512-519.
睡眠衛生指導ではEDSや夜間の不眠症状が改善されず日常生活に支障が出ている場合は、原因に応じた薬物による治療介入を考慮します。寝返り困難など、夜間から早朝にかけてのオフ症状が原因と考えられた場合にはドパミンの補充により症状の改善が期待できます。朝まで服薬のタイミングがないため、作用機序の観点から、長時間作用型のドパミンアゴニストやMAO-B阻害薬が選択肢となるでしょう。また、ドパミンアゴニストが日中の眠気の原因として考えられた場合には、ガイドラインにも記載があるように、非ドパミンアゴニストの追加及びドパミンアゴニストの減量を検討することになるでしょう。
睡眠障害は見逃されやすい症状ですが、場合によってはドパミン補充による治療が可能な非運動症状であり、患者さんのQOLやADLの向上につながります。例えば、日中過眠により一日中ぼんやりしている患者さんが適切に治療介入することで活動的になり、ADLや気分障害が改善するケースもあります。睡眠時間は1日の3分の1ですが、睡眠障害はその睡眠時間帯の不眠症状だけでなく、残りの3分の2の活動時間帯の眠気もきたす場合があります。したがって、睡眠は患者さんの1日24時間すべてのQOL・ADLに影響することから、その治療意義は大きいと考えます。
<出典>
1) 鈴木圭輔ほか. 難病と在宅ケア. 2015; 21(5): 21-25.
2) 鈴木圭輔. MDSJ Letters. 2021; 14(1): 4-6.
3) Suzuki K. J Parkinsons Dis. 2021; 11(3): 971-992.
4) Suzuki K, et al. J Neurol Sci. 2008; 271(1-2): 47-52.
5) Marinus J, et al. Lancet Neurol. 2018; 17(6): 559-568.
6) Suzuki K, et al. J Neurol Neurosurg Psychiatry. 2017; 88(11): 953-959.
7) Breen DP, et al. JAMA Neurol. 2014; 71(5): 589-595.
8) Lees AJ, et al. Clin Neuropharmacol. 1988; 11(6): 512-519.
9) Suzuki K, et al. Parkinsonism Relat Disord. 2009; 15(1): 15-19.
10) Zhang Y, et al. NPJ Parkinsons Dis. 2020; 6: 25.
11) Zhang Y, et al. Front Aging Neurosci. 2021; 13: 681773.
12) Chaudhuri KR, et al. Mov Disord. 2018; 33(6): 909-919.
13) Rizos A, et al. Parkinsonism Relat Disord. 2014; 20(11): 1231-1235.
14) Chaudhuri KR, et al. Mov Disord. 2010; 25(6): 704-709.
15) 鈴木圭輔ほか. 神経治療. 2018; 35(4): 545-552.
16) Suzuki K, et al. Acta Neurol Scand. 2015; 131(6): 426-430.
17) 鈴木圭輔ほか. 睡眠医療. 2016; 10(2): 175-185.
18) Amara AW, et al. Mov Disord. 2020; 35(6): 947-958.
私がPD診療の中でやりがいを感じる瞬間
PDは運動症状及び非運動症状に分類されるさまざまな症状があります。そのような多種多様な症状を適切に診断して治療することで、それまで患者さんが困っていた症状――その中には私が専門とする睡眠障害も含まれます――が緩和されて、患者さんから症状が良くなったと聞くことに大きな喜びを感じます。
また、PDには残念ながら今のところ疾患修飾治療薬がないため、患者さんには「現状維持を目標に病気と付き合っていきましょう」とお話しして運動療法やさまざまな薬物療法を試していきます。そんな中で日常生活でできなかったことができるようになったとか、しばらくできていなかった旅行ができたとかお話しいただくと、PDの診療に携わった甲斐があったと感じます。
PDの患者さんとのお付き合いは、10年、15年といった長いものになるため、患者さんの人生にも深く関わることとなります。患者さんからいただいた手紙の一つに印象に残る短歌がありました。
「できたはずが できない自分に 腹を立て 悲しむなかれ パーキンソン」
いつも前向きに頑張っているPD患者さんに、これからも寄り添っていきたいと思います。