アジレクト錠1mg・0.5mg 発売中
パーキンソン病診療のClinical Question パーキンソン病の起立性低血圧を考える


1 パーキンソン病(PD)患者さんにおける血圧循環調節障害の特徴と診断について、 起立性低血圧(OH)を中心に教えてください。
パーキンソン病(PD)における主な血圧循環調節障害としては、起立性低血圧(orthostatic hypotension:OH)、食事性低血圧(postprandial hypotension:PPH)、臥位性高血圧(supine hypertension :SH)、夜間高血圧(夜間血圧降下不全)などがあります1-6)。このうちOHは従来、中期から進行期のPDで多いとされてきましたが、実際には比較的早期の患者さんでも認められます7)。自覚症状がない段階であっても、検査をしてみるとOHが発覚することがあるので早期からの評価も重要です。また、SHと夜間高血圧もPD早期からそれぞれ45.8%、51.0%に認められ、しばしばOHと合併するという報告があります3,8)。
通常、起立による血圧変化の情報は、頸動脈洞や大動脈弓の圧受容器により感知され、延髄の孤束核に伝わります。そこから、一方では迷走神経背側核を介して、もう一方では延髄心臓血管運動神経中枢を経由し脊髄側核から交感神経節を介して心臓や血管へと伝わり、脈拍上昇、血管収縮などを引き起こします。孤束核からの情報は視床下部にも伝達され、下垂体からのバソプレシン分泌が亢進することで循環血漿量が増加します9)。
しかしPDでは、末梢や心臓における交感神経系の障害と中枢のレビー小体病変によってこれらの経路に障害が及び、神経原性のOHが現れます。
なおOHは脱水による循環血漿流量の減少などによっても起こることがあり、これは非神経原性OHと呼ばれます9)。
OHの症状発現には血圧の絶対値が重要で、3分間起立後の平均血圧が75mmHg未満の場合に立ちくらみなどの症状が起こりやすくなります(図1)10)。
![ALC_3分間起立後の平均血圧とOHの症状の有無[海外データ]](/sites/default/files/2024-06/ALC_3%E5%88%86%E9%96%93%E8%B5%B7%E7%AB%8B%E5%BE%8C%E3%81%AE%E5%B9%B3%E5%9D%87%E8%A1%80%E5%9C%A7%E3%81%A8OH%E3%81%AE%E7%97%87%E7%8A%B6%E3%81%AE%E6%9C%89%E7%84%A1%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD_0.png)
![ALC_3分間起立後の平均血圧とOHの症状の有無[海外データ]](/sites/default/files/2024-06/ALC_3%E5%88%86%E9%96%93%E8%B5%B7%E7%AB%8B%E5%BE%8C%E3%81%AE%E5%B9%B3%E5%9D%87%E8%A1%80%E5%9C%A7%E3%81%A8OH%E3%81%AE%E7%97%87%E7%8A%B6%E3%81%AE%E6%9C%89%E7%84%A1%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD_1.png)
【対象・方法】
PD患者210例を対象とし、仰臥位および立位(受動的または能動的)の血圧を測定するとともに、バリデーション済みの患者報告アウトカム質問票を用い、症候性OHについて確認した。加えて、症候性OHを判別するうえで2つの診断基準[3分間起立後のSBP/DBPが①20/10mmHg以上低下、②30/15mmHg以上低下]が有用であるかを評価し、PD患者コホートにおける血圧と症状との関係を検討した。
【解析計画】
血圧連続変数に関する群間差は対応のないt検定を用いて評価した。また患者を症状の有無により分類し、χ2検定を用いてデータを解析した。すべての検定は両側で行い、p<0.05である場合に有意差ありとした。
【リミテーション】
対象としたコホートのうち、米国コホートはOHの疑いで自律神経障害センターに紹介された患者であったため、選択バイアスが存在しうる。本研究ではOHを「実質的なオフ時」に評価したものの、ほぼすべての患者がPD治療薬を使用しており、その残存効果がOHの悪化に寄与した可能性がある。一部患者が服用していた低血圧治療薬が、臥位性高血圧に影響を与えた可能性もある。また今回は遅延性(起立後3分超経過した場合)のOHについて検討しておらず、脳血流の評価も実施していない。さらに、本研究ではOHについて能動的/受動的試験のどちらを行うかを、地理的な理由により決定した。
Palma J-A, et al. Mov Disord. 2015; 30(5): 639-645. より改変
また、一過性のOHであったとしても、転倒を起こすと報告されています11)。PDによる歩行障害にこうした症状が加わると容易に転倒し、外傷や骨折による運動障害によってPDがますます進行する可能性があります。実際に、OHを有するPD患者さんの予後は不良であると報告されています(ハザード比2.44、p=0.0055、年齢と性別で調整したCox回帰分析)12)。
また、PDにおける血圧循環調節障害は、認知機能障害にも影響するといわれています13)。
たとえばOHを有するPD患者さんでは、非OH群と比較して、認知機能と関連する大脳皮質の前部帯状回の灌流低下が報告されています14)。さらに、前部帯状回や脳幹の青斑核といった、自律神経/血圧調節機能と認知機能の両方に関与する脳領域へのαシヌクレインの進展が認知機能に影響を与えるという説や13,15)、血圧変動の異常が大脳白質病変を増悪させ、結果的に認知機能へ影響を与えるとの説もあります(図2)15)。
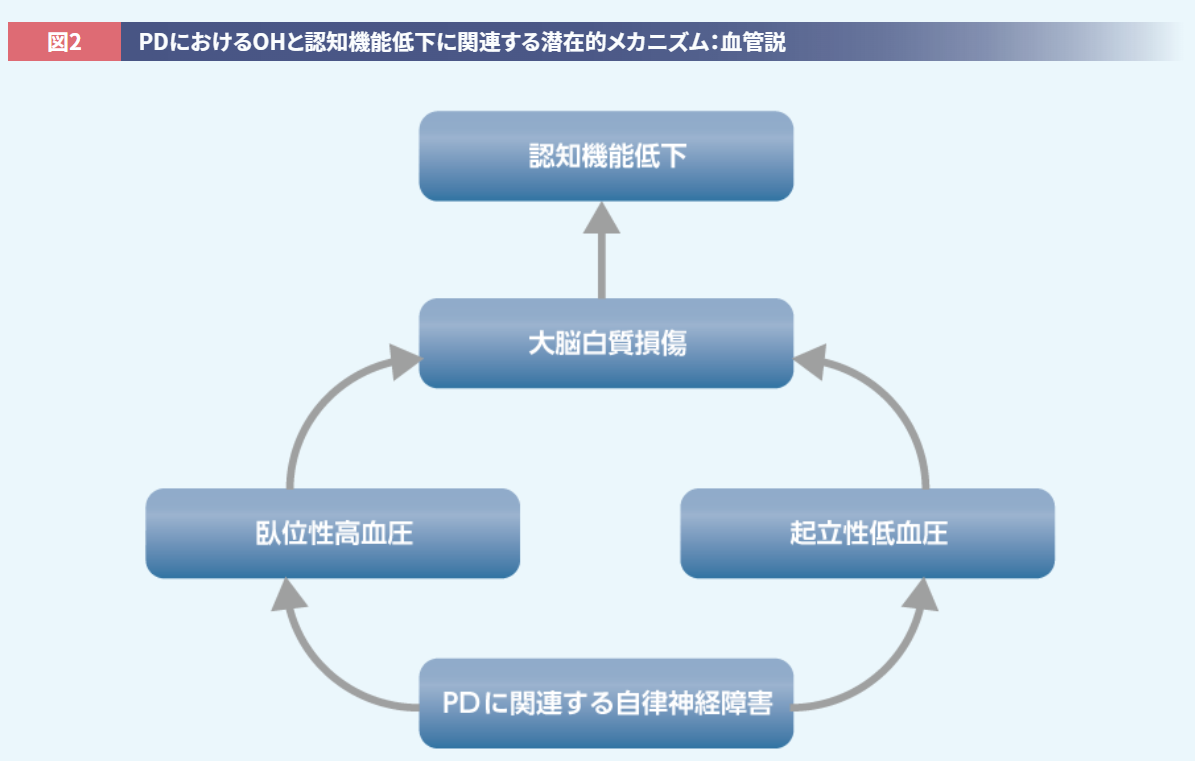
McDonald C, et al. Mov Disord. 2016; 31(7): 937-946.
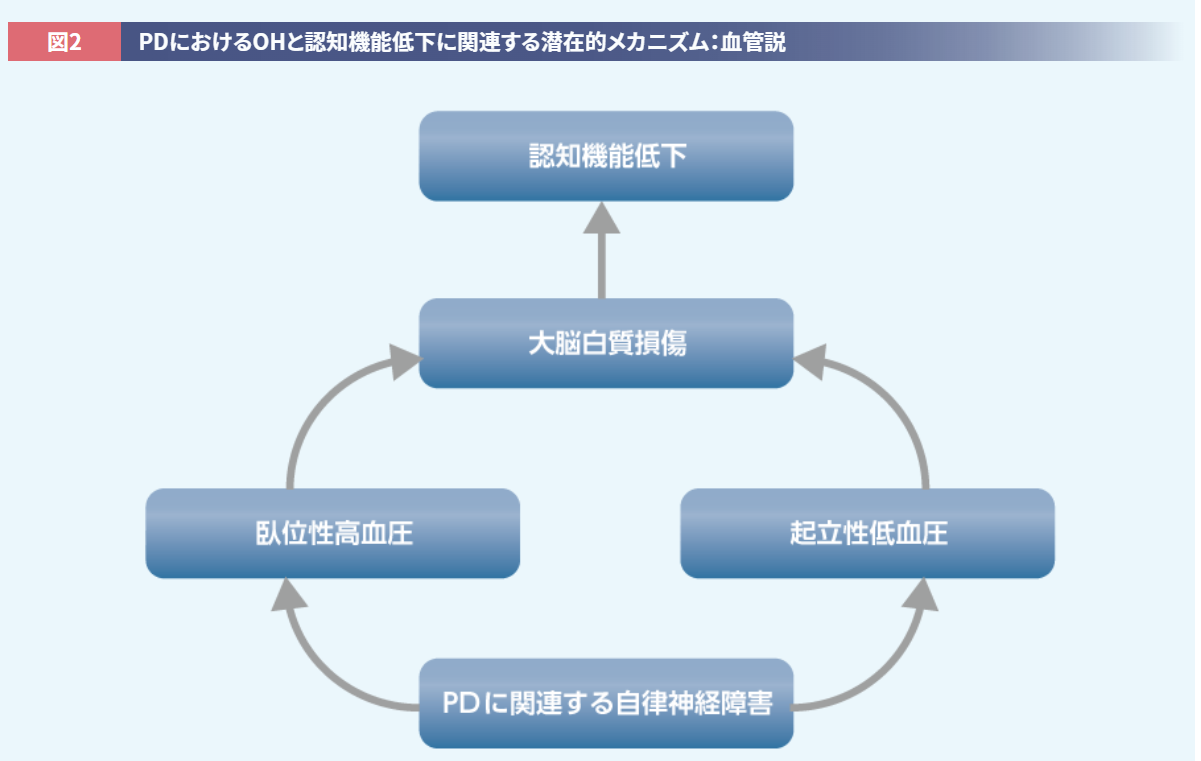
McDonald C, et al. Mov Disord. 2016; 31(7): 937-946.
OHの診断は、能動的ないし受動的起立試験により行います。能動的起立試験(Schellong試験)は、3~5分間の臥位後に患者さん自身が起立し、その後の血圧測定によりOHを診断するものです。一方、受動的起立試験では、ティルトテーブルを利用して臥位から立位への体位変換を行います9)。PPH、SH、および夜間高血圧の診断は、それぞれ75g経口ブドウ糖負荷試験中の血圧測定、安静臥位での血圧測定、および24時間血圧測定により行うことができます3,6,16)。
これらの検査の中でも、Schellong試験や24時間血圧測定は比較的容易に実施可能で、特に後者は血圧の異常変動を検出しやすい有用な検査法です。OHを主とする血圧循環調節障害が予後や認知機能に影響を及ぼすことを考えると、PD患者さんでは早期からこれらの検査を行うことが勧められます。
2 PD治療薬は血圧循環調節障害にどのような影響を及ぼしますか?
「パーキンソン病診療ガイドライン2018」では、早期PDに対する治療薬としてL-ドパ、ドパミンアゴニスト、MAO-B阻害薬が推奨されています7)。一方で、これらの薬剤が血圧循環調節障害、特にOHを引き起こす可能性を持つことは以前から指摘されており、こうした影響の有無を検討する研究も多数行われてきました17,18)。
それらの結果から、PD治療薬はいずれも血圧変動に影響を与える可能性があると考えられます。つまり、どの薬剤を用いる場合にもOHへの注意を怠ってはならず、今後も各薬剤に関する安全性のデータを蓄積し続ける必要があります。
また、前述のとおりOHは神経原性と非神経原性に分別され、非神経原性OHは身体要因および環境要因の影響を受けます。たとえば高身長19)やBMI低値20,21)がOHに関連することを考慮すると、患者さんの体格、特にフレイルやサルコペニアを伴う高齢者特有の「痩せ」は、OHに大きな影響を及ぼすと推測されます。このようにPD患者さんがOHを起こすかどうかは、治療薬だけの問題ではなくケースバイケースであり、患者さんの背景を考慮した治療選択が重要となります(図3)。なお、PD患者さんのOHに対し昇圧薬を使用する際には、効果を確認しながら段階的に増量し、効果がみられない場合には漫然と投与しないことが重要です。
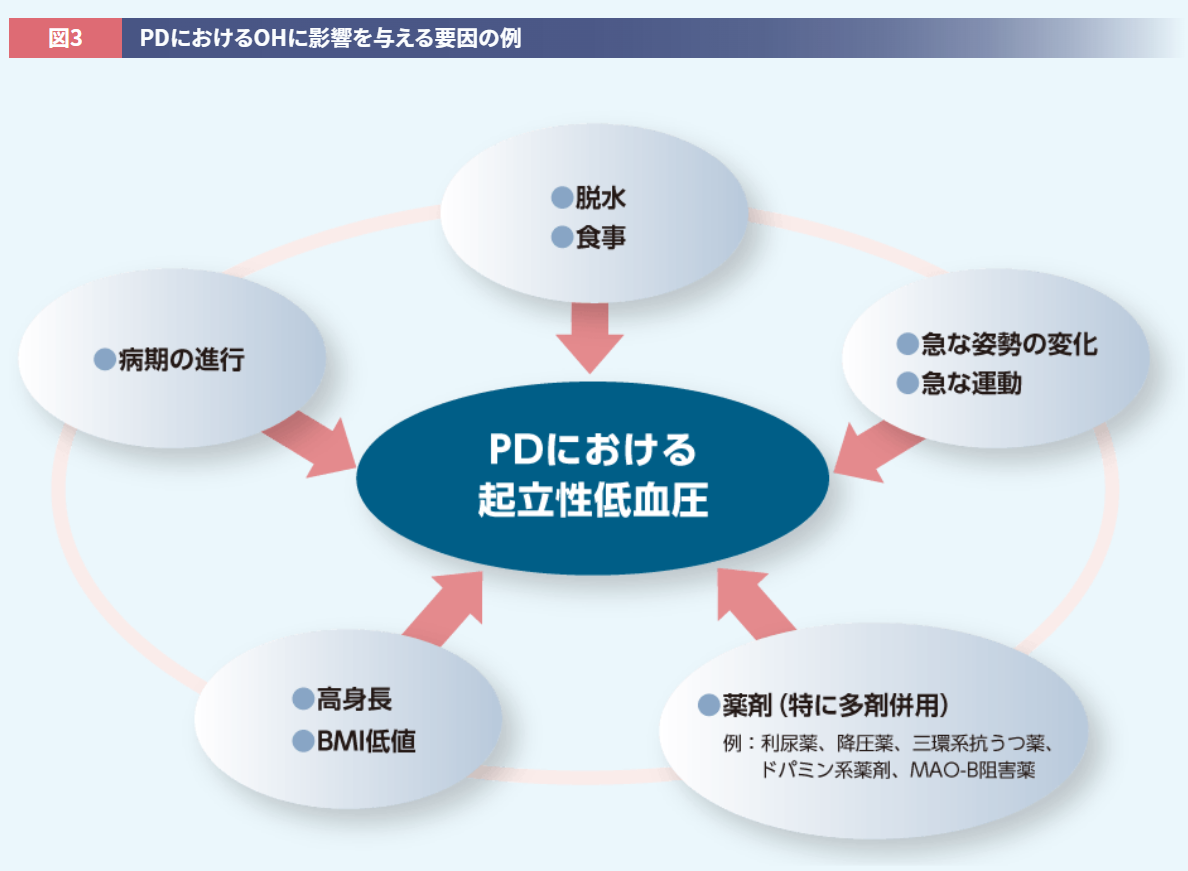
監修:岡 尚省 先生
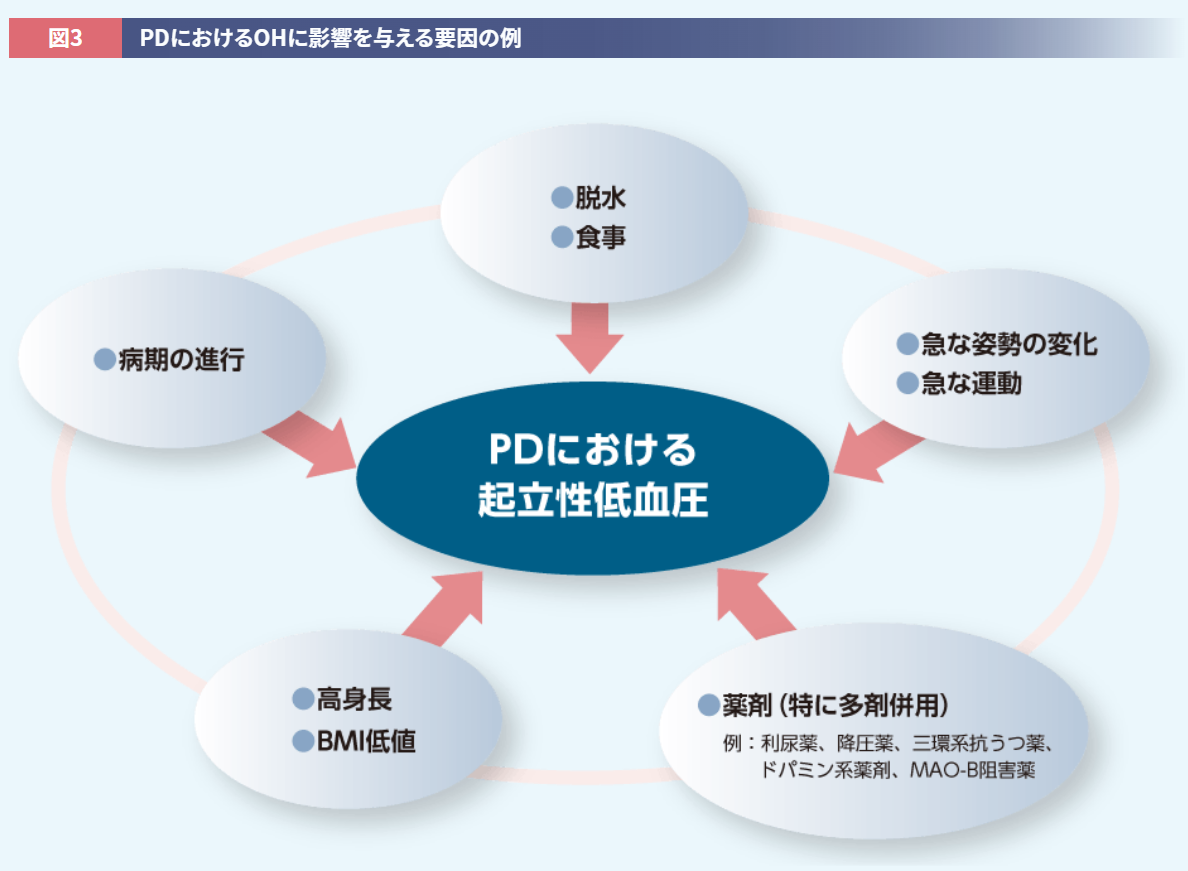
監修:岡 尚省 先生
3 COVID-19時代を踏まえたOHへの対応について教えてください。
COVID-19のパンデミック下では日常生活における運動量が低下し、フレイルにつながりやすいなどの影響が考えられます。また、マスクの常時着用により水分摂取量が減少すると、循環血流量が減少して血圧調節不全となる可能性もあります。これらはいずれも、PD患者さんにおける非神経原性OHの増加につながると予測されます。
こうした状況のなか、患者さんが運動の継続で起立時の血圧低下を改善するという報告もあります(図4)22)。加えて、運動はフレイルやサルコペニアなどの予防にもつながります。ただし、急な運動は低血圧を誘発することがあるため、注意が必要です23)。
![ALC_漸増的レジスタンストレーニング(RT)実施PD患者(PDT群)および非実施PD患者(PDC群)における起立負荷に対する収縮期血圧の変化[海外データ]](/sites/default/files/2024-06/ALC_%E6%BC%B8%E5%A2%97%E7%9A%84%E3%83%AC%E3%82%B8%E3%82%B9%E3%82%BF%E3%83%B3%E3%82%B9%E3%83%88%E3%83%AC%E3%83%BC%E3%83%8B%E3%83%B3%E3%82%B0%EF%BC%88RT%EF%BC%89%E5%AE%9F%E6%96%BDPD%E6%82%A3%E8%80%85%EF%BC%88PDT%E7%BE%A4%EF%BC%89%E3%81%8A%E3%82%88%E3%81%B3%E9%9D%9E%E5%AE%9F%E6%96%BDPD%E6%82%A3%E8%80%85%EF%BC%88PDC%E7%BE%A4%EF%BC%89%E3%81%AB%E3%81%8A%E3%81%91%E3%82%8B%E8%B5%B7%E7%AB%8B%E8%B2%A0%E8%8D%B7%E3%81%AB%E5%AF%BE%E3%81%99%E3%82%8B%E5%8F%8E%E7%B8%AE%E6%9C%9F%E8%A1%80%E5%9C%A7%E3%81%AE%E5%A4%89%E5%8C%96%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD.png)
![ALC_漸増的レジスタンストレーニング(RT)実施PD患者(PDT群)および非実施PD患者(PDC群)における起立負荷に対する収縮期血圧の変化[海外データ]](/sites/default/files/2024-06/ALC_%E6%BC%B8%E5%A2%97%E7%9A%84%E3%83%AC%E3%82%B8%E3%82%B9%E3%82%BF%E3%83%B3%E3%82%B9%E3%83%88%E3%83%AC%E3%83%BC%E3%83%8B%E3%83%B3%E3%82%B0%EF%BC%88RT%EF%BC%89%E5%AE%9F%E6%96%BDPD%E6%82%A3%E8%80%85%EF%BC%88PDT%E7%BE%A4%EF%BC%89%E3%81%8A%E3%82%88%E3%81%B3%E9%9D%9E%E5%AE%9F%E6%96%BDPD%E6%82%A3%E8%80%85%EF%BC%88PDC%E7%BE%A4%EF%BC%89%E3%81%AB%E3%81%8A%E3%81%91%E3%82%8B%E8%B5%B7%E7%AB%8B%E8%B2%A0%E8%8D%B7%E3%81%AB%E5%AF%BE%E3%81%99%E3%82%8B%E5%8F%8E%E7%B8%AE%E6%9C%9F%E8%A1%80%E5%9C%A7%E3%81%AE%E5%A4%89%E5%8C%96%EF%BC%BB%E6%B5%B7%E5%A4%96%E3%83%87%E3%83%BC%E3%82%BF%EF%BC%BD_0.png)
【対象・方法】
修正Hoehn & Yahrステージ2~3のPD患者30例を漸増的レジスタンストレーニング(RT)実施(PDT)群および非実施(PDC)群に無作為化し、PDT群では5種類のレジスタンス運動(12RM2セットから6RM4セットに漸増)を行わせた。試験開始前と12週後、両群において自律神経機能(心拍変動のスペクトル解析と自律神経負荷試験に対する心血管系反応に基づく)を評価した。年齢と性別で対にした健常対照(HC)群でも、同様の評価を1回実施した。
【解析計画】
患者特性の群間差は1元配置分散分析ないしχ2検定で比較した。漸増的RTの効果は、患者群間(PDT vs PDC)を主因子、群内の時間(ベースラインおよび12週後)を主因子とした2元配置分散分析で評価した。p≦0.05である場合に統計学的に有意とみなした。
【リミテーション】
1)本試験の対象は修正Hoehn & Yahr ステージ2~3で試験開始時に高血圧や心疾患のないPD患者のみであり、これらの特性を持たない被験者に結果を一般化することはできない。2)PD患者は異なる薬剤および用量による治療を受けていたため、特定の薬剤レジメンに結果を外挿することはできない。3)心拍変動の生理学的パラメータの解釈には議論がある。4)本研究は12週間の特定の漸増的RTプログラムが有する効果を評価したものである。5)PDT群とHC群のデータに差がないことは、健常者と同等であることを意味しない。6)本研究では追跡調査を行わなかった。
Kanegusuku H, et al. Arch Phys Med Rehabil. 2017; 98(11): 2134-2141.
血圧循環調節障害に対して患者さんご自身が実施可能な対策としては、日常的な運動や腹帯の使用、十分な水分摂取、食事回数の増加などが挙げられます(図5)。このうち水分摂取の有効性については、純粋自律神経機能不全症の患者さん19例において報告がなされています。480mLの飲水後、血圧は30~35分後に最大に達し、60分以上持続したとの結果であり、OHの軽減にも有効であることが示唆されます24)。

監修:岡 尚省 先生

監修:岡 尚省 先生
また食後の運動を避けることは、OHやPPH、運動誘発性低血圧の予防になります。
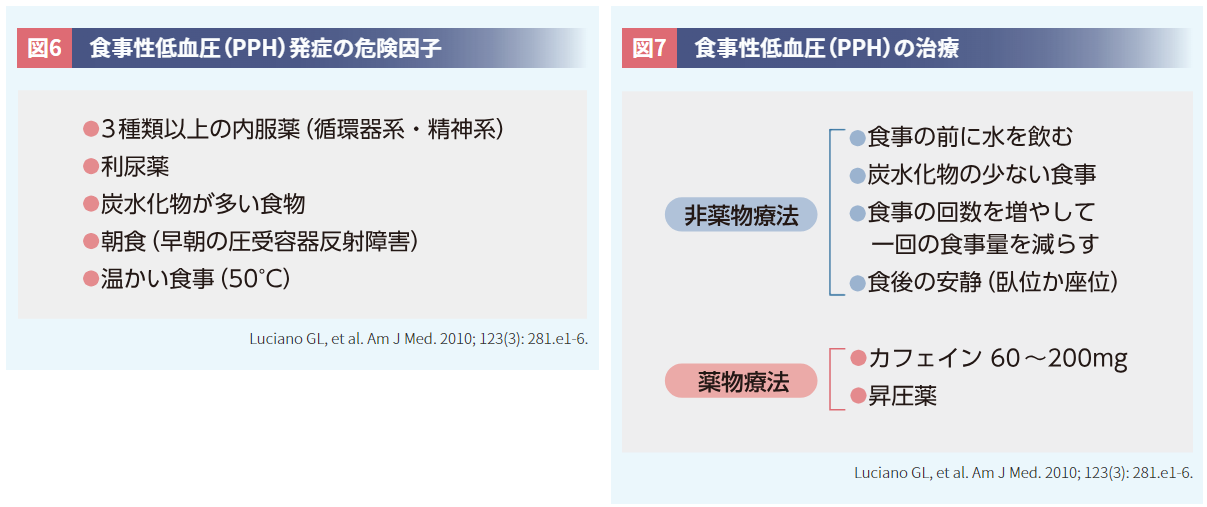
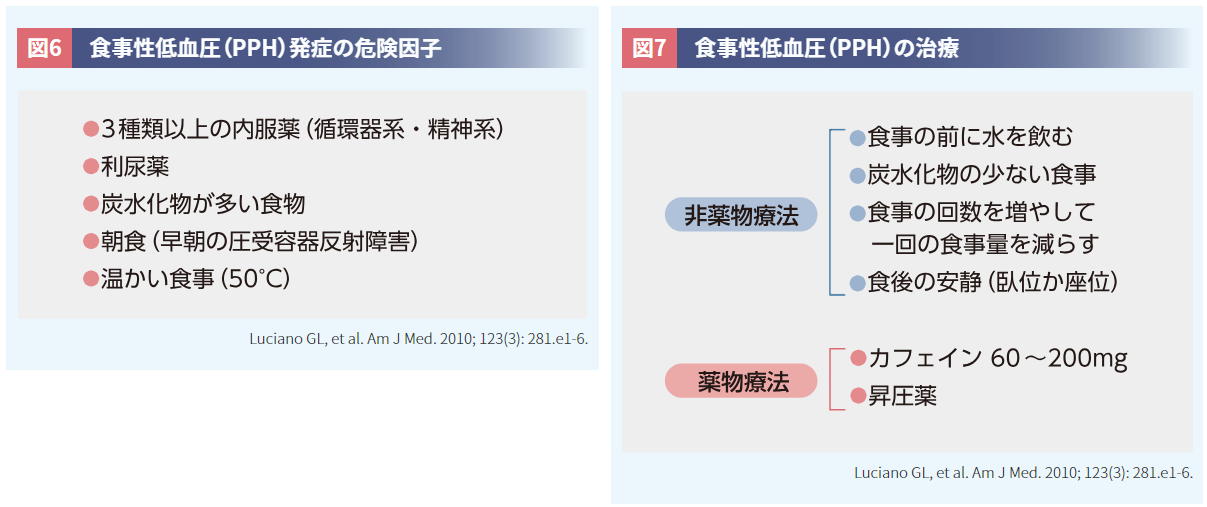
PPHは食事に関する危険因子が多く(図6)25)、対策として、一回の食事量の調整や炭水化物の少ない食事への変更、カフェインの摂取等が有効です(図7)25)。
OHに対しては、臥位から立位に移るときに緩徐な動作を心がけること、息こらえや力みを避けることなども有効です。就寝時に毛布を背中に入れて上半身が高くなるようにすると夜間のSHを防ぐことができ(p<0.05、Wilcoxonの順位和検定)、日中のOH予防にもなります26)。血圧が低下したときの対策としては、脚を交差したり前屈みやスクワットの体位をとったりすることが挙げられます(図8)27)。
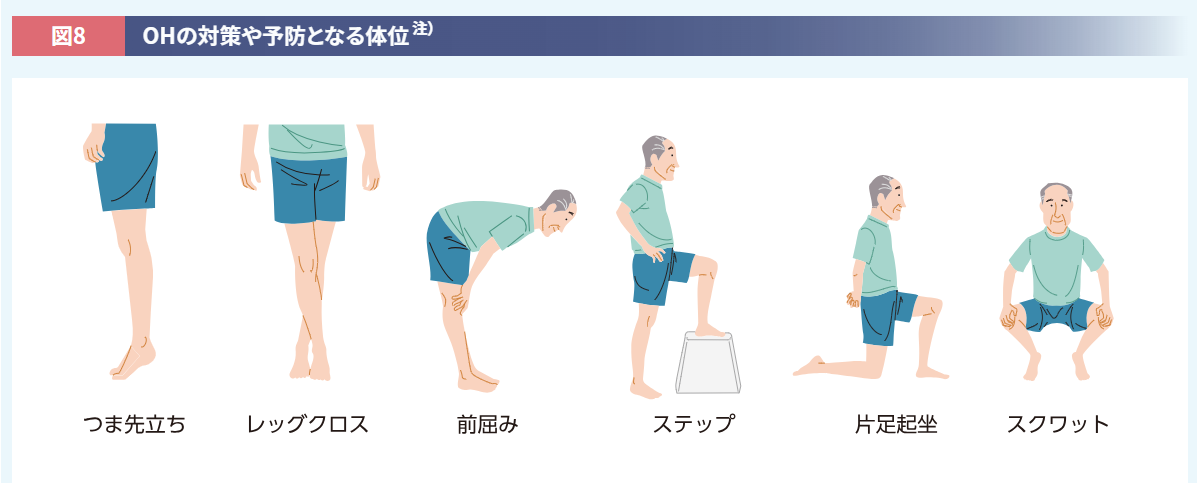
注) 患者さんの状態に合わせて介護者に付き添っていただくなど、転倒しないよう十分注意すること。
監修:岡 尚省 先生
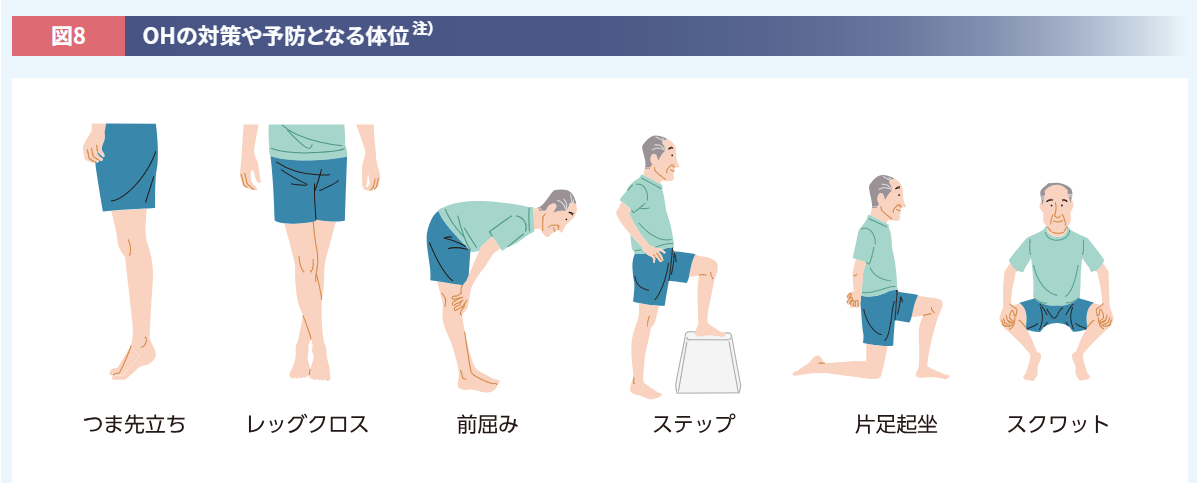
注) 患者さんの状態に合わせて介護者に付き添っていただくなど、転倒しないよう十分注意すること。
監修:岡 尚省 先生
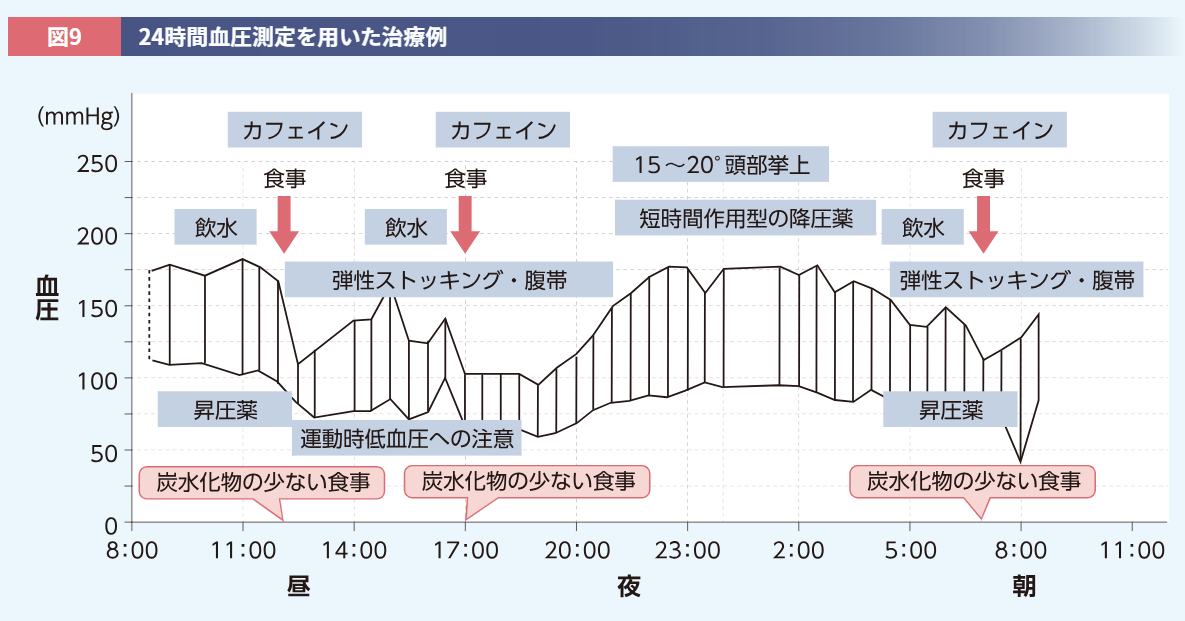
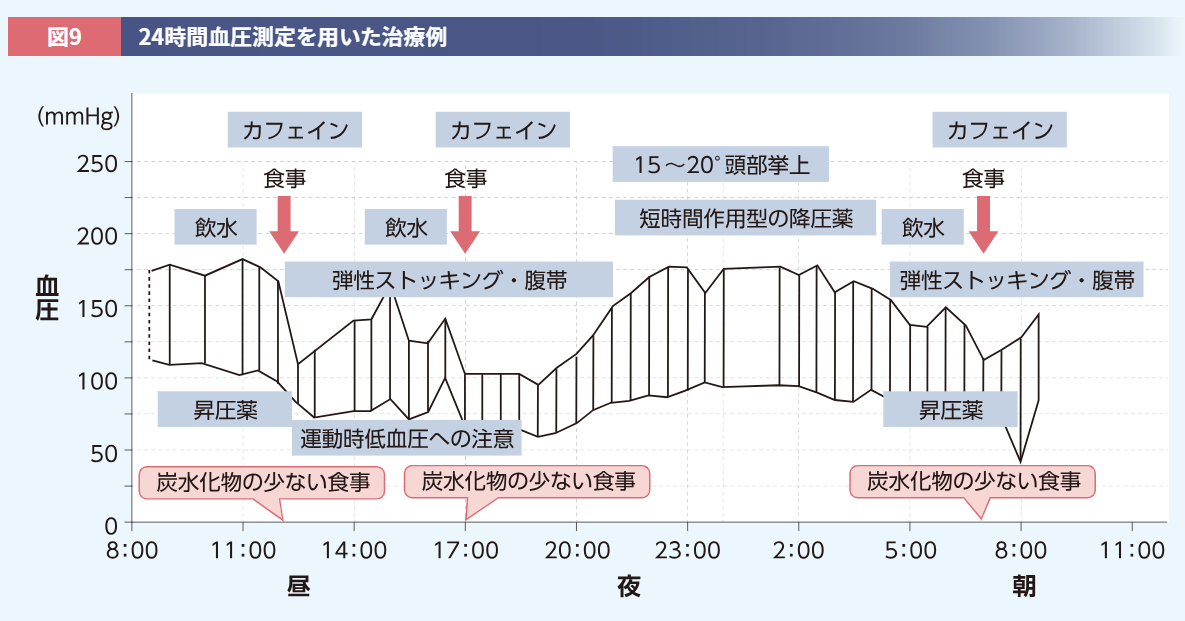
このような対策を患者さんになかなか実行してもらえない場合は、ご家族にもお話しし、一緒に行動していただくとよいでしょう。特に運動を行う際には、転倒の可能性も考え、付き添っていただくことが重要です。例として、24時間血圧測定を実施し、治療を行う際のイメージをご提示します(図9)。このように患者さんの状態に合わせて、適切な指導や治療を行うことが重要です。
監修:岡 尚省 先生
監修:岡 尚省 先生
<出典>
1) Neurology. 1996; 46(5): 1470.
2) Lipsitz LA, et al. Am J Cardiol. 1986; 58(9): 810-815.
3) Umehara T, et al. Clin Auton Res. 2016; 26(1): 15-21.
4) Fanciulli A, et al. Clin Auton Res. 2018; 28(4): 355-362.
5) Manabe Y, et al. J Neurol Sci. 2011; 307(1-2): 153-156.
6) Oka H, et al. Eur Neurol. 2018; 79(5-6): 281-286.
7) 日本神経学会監修,「 パーキンソン病診療ガイドライン」作成委員会編,
「パーキンソン病診療ガイドライン2018」.東京:医学書院,2018.
8) Oka H, et al. BMC Neurol. 2020; 20(1): 350.
9) 岡 尚省. 神経治療. 2015; 32: 334-337.
10) Palma J-A, et al. Mov Disord. 2015; 30(5): 639-645.
11) Fanciulli A, et al. Neurology. 2020; 95(21): e2854-e2865.
12) Goldstein DS, et al. Neurology. 2015; 85(18): 1554-1561.
13) Espay AJ, et al. Mov Disord. 2014; 29(14): 1710-1719.
14) Matsui H, et al. Acta Neurol Scand. 2005; 112(1): 36-41.
15) McDonald C, et al. Mov Disord. 2016; 31(7): 937-946.
16) Umehara T, et al. Parkinsonism Relat Disord. 2014; 20(6): 573-577.
17) Sánchez-Ferro A, et al. Front Neurol. 2013; 4: 64.
18) Nimmons D, et al. J Geriatr Psychiatry Neurol. 2022; 35(5): 639‒654.
19) Campese N, et al. Mov Disord. 2021; 36(11): 2703-2705.
20) Nakamura T, et al. J Neurol Sci. 2017; 372: 14-18.
21) Umehara T, et al. Acta Neurol Scand. 2017; 135(5): 560-567.
22) Kanegusuku H, et al. Arch Phys Med Rehabil. 2017; 98(11): 2134-2141.
23) Low DA, et al. Auton Neurosci. 2012; 171(1-2): 66-78.
24) Jordan J, et al. Circulation. 2000; 101(5): 504-509.
25) Luciano GL, et al. Am J Med. 2010; 123(3): 281.e1-6.
26) van Lieshout JJ, et al. Clin Auton Res. 2000; 10(1): 35-42.
27) Low PA, Singer W. Lancet Neurol. 2008; 7(5): 451-458.
私がPD診療の中でやりがいを感じる瞬間
ひとつは、症状が発現しているにもかかわらず、PDの診断を受けていなかった患者さんに対して確実な診断を行うことができ、治療方針が決まったときです。PDが決して悲観する病気ではないことを、患者さんとご家族に時間をかけて慎重にお話ししてご理解いただき、治療の方向性が定まった瞬間にはやりがいを感じます。
もうひとつは、以前はできなかった行為や仕事が、治療後にできるようになったと報告を受けたときです。薬剤を調整しながら治療を続けることで、こうした良好な状態が長く続き、10年、20年が経過したことにふと気づくと、喜びがこみ上げてきます。
PD患者さんが最も困っていることは一人一人異なりますので、私は診察時の会話でそれぞれの問題をみつけ、解決する方法を患者さんやご家族と一緒に考えることを心がけています。また、ご家族が気づかないような少しの症状改善であっても、診察時にできるだけみつけて褒めるようにしています。患者さんも嬉しく感じるようで、ご家族から、診察後にはいつも症状がよくなると報告いただくことがあります。こうした工夫が患者さんのやる気につながり、前向きに日常生活を送る手助けになればと願っています。