アルンブリグ錠 30mg・90mg 発売中
Caseで診る肺癌診療~高齢者機能評価を用いた治療選択~


<症例像>
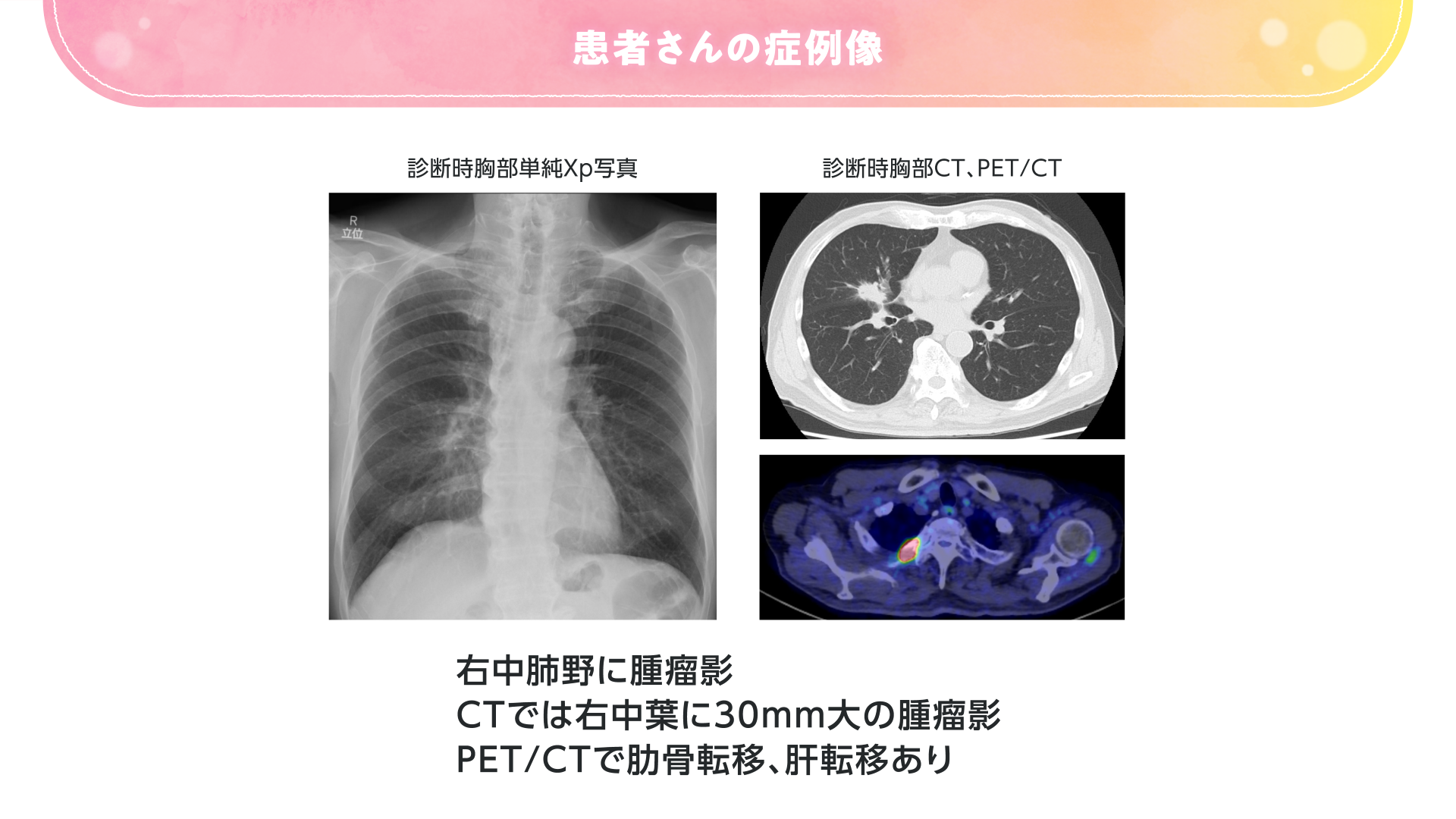
- 症例:83歳 男性
- 非小細胞肺癌(腺癌) cT2N0M1c Stage Ⅳb
- ドライバー遺伝子変異/転座陰性、PD-L1 TPS 20%
- 【喫煙歴】なし
- 【併存疾患】高血圧症
- 【PS】1(労作時呼吸困難あり)
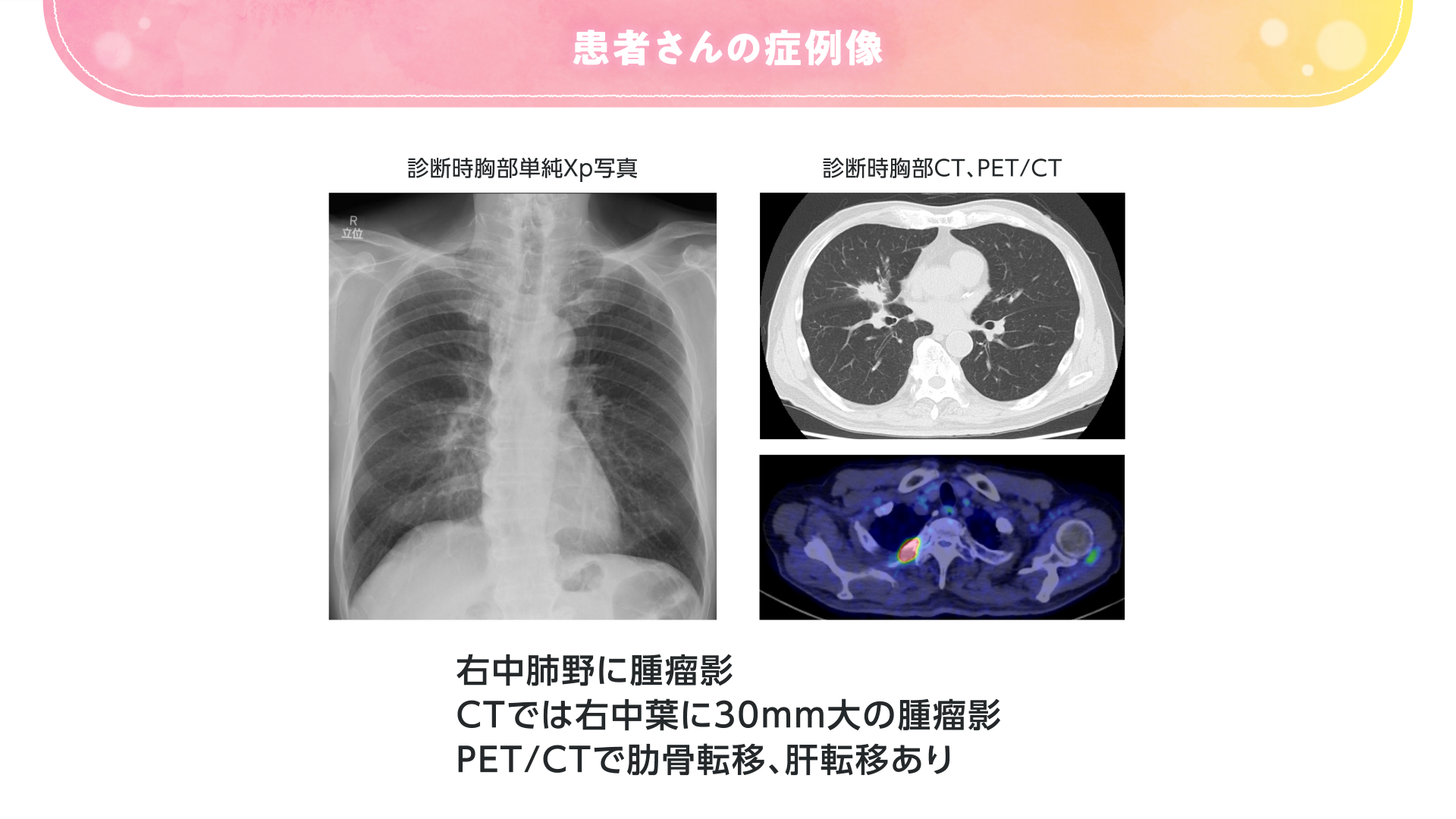
- 症例:83歳 男性
- 非小細胞肺癌(腺癌) cT2N0M1c Stage Ⅳb
- ドライバー遺伝子変異/転座陰性、PD-L1 TPS 20%
- 【喫煙歴】なし
- 【併存疾患】高血圧症
- 【PS】1(労作時呼吸困難あり)
肺癌診療ガイドライン 2024年版では、「全身状態良好(PS 0-1)なPD-L1 TPS 1~49%に対する一次治療にお
いて薬物療法は勧められるか?」とのCQに対して以下の推奨であり2)、まず検討すべきはプラチナ製剤併用療法
とPD-1/PD-L1阻害薬の併用療法になると考えられます。

本著作物は日本肺癌学会が作成したものであり、本著作物の内容に関する質問、 問い合わせ等は日本肺癌学会にご連絡ください。
武田薬品工業株式会社は、日本肺癌学会及び発行元である金原出版から許諾を得て、本著作物を内容の改変を行うことなく複製し、使用しています。
本患者さんは83歳と暦年齢は高いものの、PS1で、併存疾患も高血圧症のみです。この場合、細胞傷害性抗癌薬を使用するか否かがポイントになると考えられます。

本著作物は日本肺癌学会が作成したものであり、本著作物の内容に関する質問、 問い合わせ等は日本肺癌学会にご連絡ください。
武田薬品工業株式会社は、日本肺癌学会及び発行元である金原出版から許諾を得て、本著作物を内容の改変を行うことなく複製し、使用しています。
本患者さんは83歳と暦年齢は高いものの、PS1で、併存疾患も高血圧症のみです。この場合、細胞傷害性抗癌薬を使用するか否かがポイントになると考えられます。
先生は、このような患者さんに対し、どのように評価を進められますか?
<治療方針決定までの全体像>
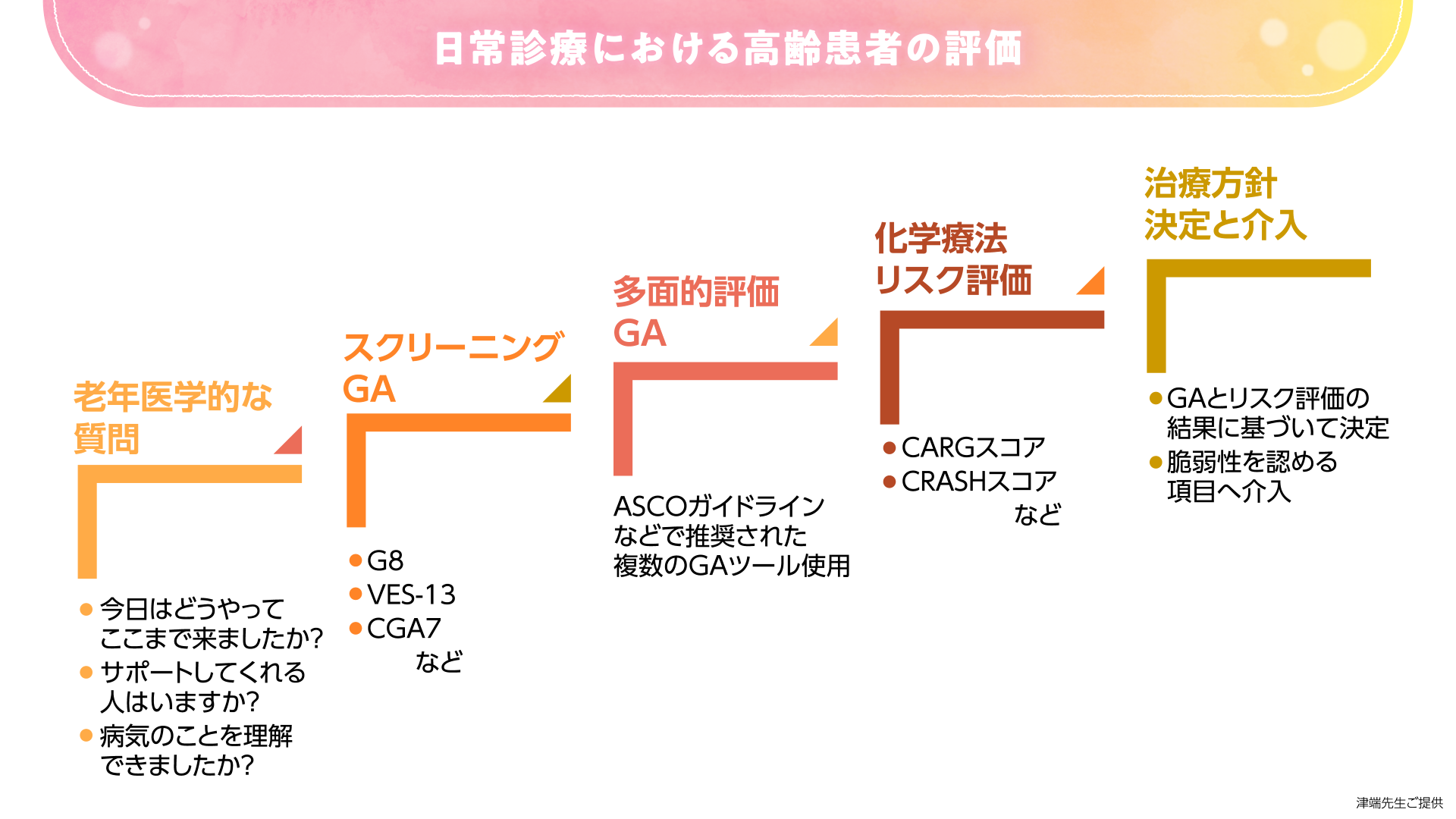
NCCN ガイドライン(非小細胞肺癌)では、高齢癌患者の治療方針決定に関するフローチャートが示されています。
(*上記の図は津端先生にご提供いただいたものであり、NCCNガイドラインとは関係ありません。)
本フローチャートでは、はじめに予後予測を行い、次に患者さんが自身の病状を理解できるか、治療方針の決定および受け入れが可能かを認知機能の結果をもとに評価します。論理的思考が可能で自身の選択を表明できる場合には、抗癌薬治療の適応と判断されます。その場合、主治医と治療の目標・価値観が一致していることを確認したうえで化学療法のリスク評価へと進みます。
このように高齢癌患者さんに対しては高齢者機能評価(geriatric assessment:GA)の実施が重要です。GAはスクリーニングと包括的な評価に分けて考えることができます。まずはスクリーニングGAを実施し、脆弱性が認められた場合に包括的GAでより詳細に評価していきます。
包括的GAの結果、脆弱な項目が改善可能であれば介入方法を検討し、改善不可能な場合には標準治療から毒性の低い代替療法を検討します。
本患者さんの場合、スクリーニングおよび多面的GAで栄養状態や身体機能、認知機能などに脆弱性が認められない、あるいは介入可能であれば、次に細胞障害性抗癌薬による有害事象予測を行います。
最終的な治療方針は、これらのGAおよび有害事象予測の結果を患者さんと共有し、化学療法で起こりうる有害事象を許容できるかどうか相談したうえで決定します。
このときポイントとなるのが、何を治療目標と考えるかは患者さんごとに異なるという点です。最近では社会や家庭で役割のある高齢患者さんが増加しており、高齢者でも治療効果によるADLの改善を期待される患者さんが多い印象です。よって、私は、“高齢者だから”と先入観をもたず、患者さんが治療に望むことや治療に対する好みを聞きながら、治療方針を決定していくことを心掛けています。
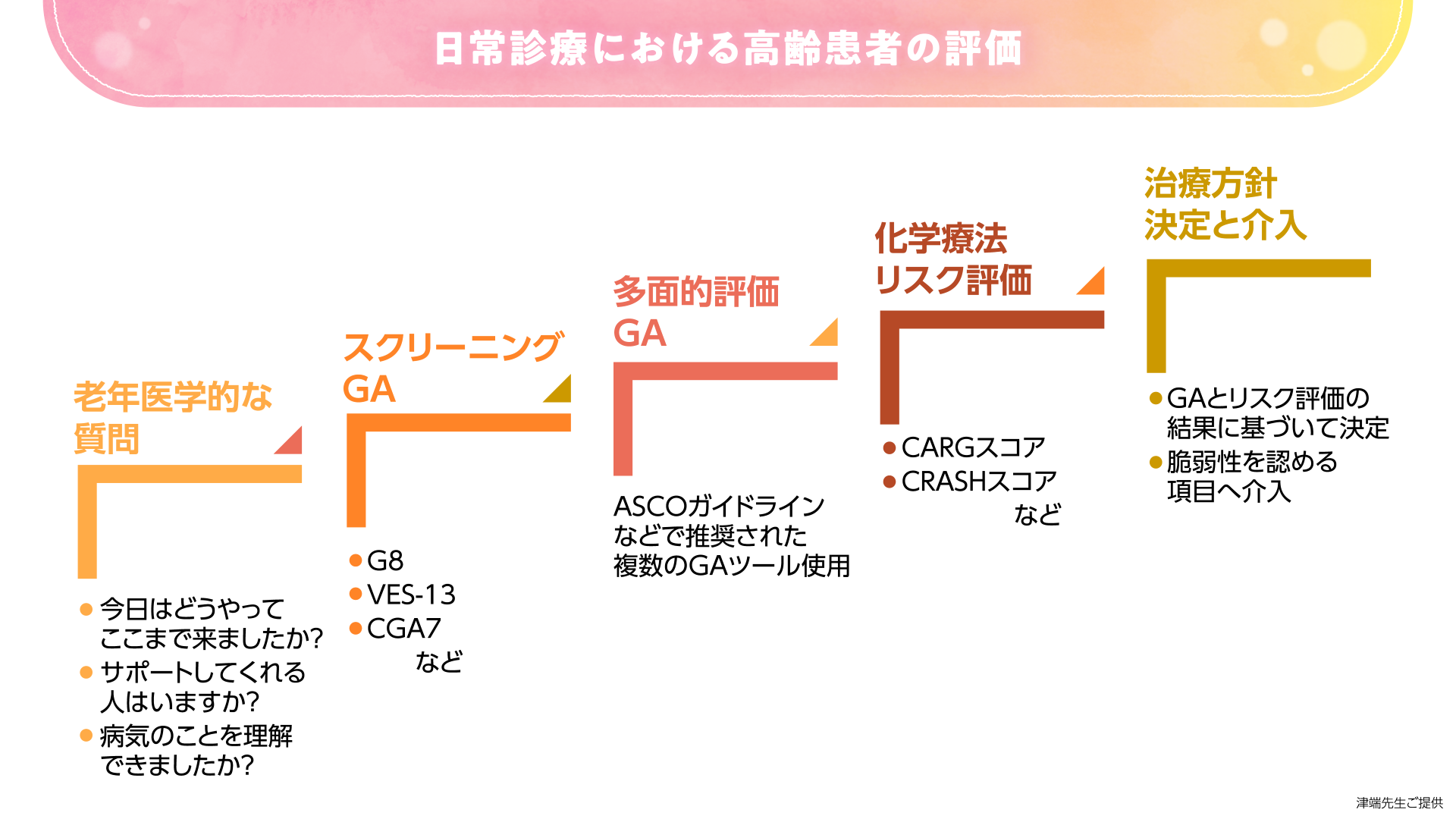
NCCN ガイドライン(非小細胞肺癌)では、高齢癌患者の治療方針決定に関するフローチャートが示されています。
(*上記の図は津端先生にご提供いただいたものであり、NCCNガイドラインとは関係ありません。)
本フローチャートでは、はじめに予後予測を行い、次に患者さんが自身の病状を理解できるか、治療方針の決定および受け入れが可能かを認知機能の結果をもとに評価します。論理的思考が可能で自身の選択を表明できる場合には、抗癌薬治療の適応と判断されます。その場合、主治医と治療の目標・価値観が一致していることを確認したうえで化学療法のリスク評価へと進みます。
このように高齢癌患者さんに対しては高齢者機能評価(geriatric assessment:GA)の実施が重要です。GAはスクリーニングと包括的な評価に分けて考えることができます。まずはスクリーニングGAを実施し、脆弱性が認められた場合に包括的GAでより詳細に評価していきます。
包括的GAの結果、脆弱な項目が改善可能であれば介入方法を検討し、改善不可能な場合には標準治療から毒性の低い代替療法を検討します。
本患者さんの場合、スクリーニングおよび多面的GAで栄養状態や身体機能、認知機能などに脆弱性が認められない、あるいは介入可能であれば、次に細胞障害性抗癌薬による有害事象予測を行います。
最終的な治療方針は、これらのGAおよび有害事象予測の結果を患者さんと共有し、化学療法で起こりうる有害事象を許容できるかどうか相談したうえで決定します。
このときポイントとなるのが、何を治療目標と考えるかは患者さんごとに異なるという点です。最近では社会や家庭で役割のある高齢患者さんが増加しており、高齢者でも治療効果によるADLの改善を期待される患者さんが多い印象です。よって、私は、“高齢者だから”と先入観をもたず、患者さんが治療に望むことや治療に対する好みを聞きながら、治療方針を決定していくことを心掛けています。
先生は、普段の診療で、高齢患者さんの認知機能を どのように評価していますか?
<認知機能の評価(老年医学的な質問)>
認知機能の評価や、治療目標・価値観の一致の確認は、老年医学的な質問を通して評価することができます。
医師が日常的に患者さんに聞いている「今日はどうやってここまで来ましたか?」「サポートしてくれる人はいますか?」「病気のことを理解できましたか?」などの質問が認知機能評価の最初のステップと考えます。
認知機能や身体機能の評価結果を、 どのように治療方針の決定に反映させていますか?
<高齢者機能評価のための具体的なツール>
老年医学的な質問による認知機能や身体機能の評価は、可視化することで適切に治療方針に反映することができます。また、可視化することにより他のメディカルスタッフと情報共有することもできます。
これらの評価結果を可視化するためには、体系的に作られた評価票を用いることがポイントで、そのためのツールとしてさまざまなスコアが存在します。
まずはGeriatric 8、CGA7などのスクリーニングツール(図1)を使用するのがよいと考えられます。スクリーニングの結果、脆弱性が認められた場合に、より詳細なGAとして、米国腫瘍臨床学会(ASCO)ガイドラインで推奨されるような複数のGAツールを使用することが望ましいと考えます。化学療法のリスクを評価するツールとしてはCARG(Cancer and Aging Research Group)スコアや、CRASH(Chemotherapy Risk Assessment Scale for High-Age Patients)スコアなどがあります(図2)。これらのツールを用いて、有害事象の予測スコアを算出することができます。
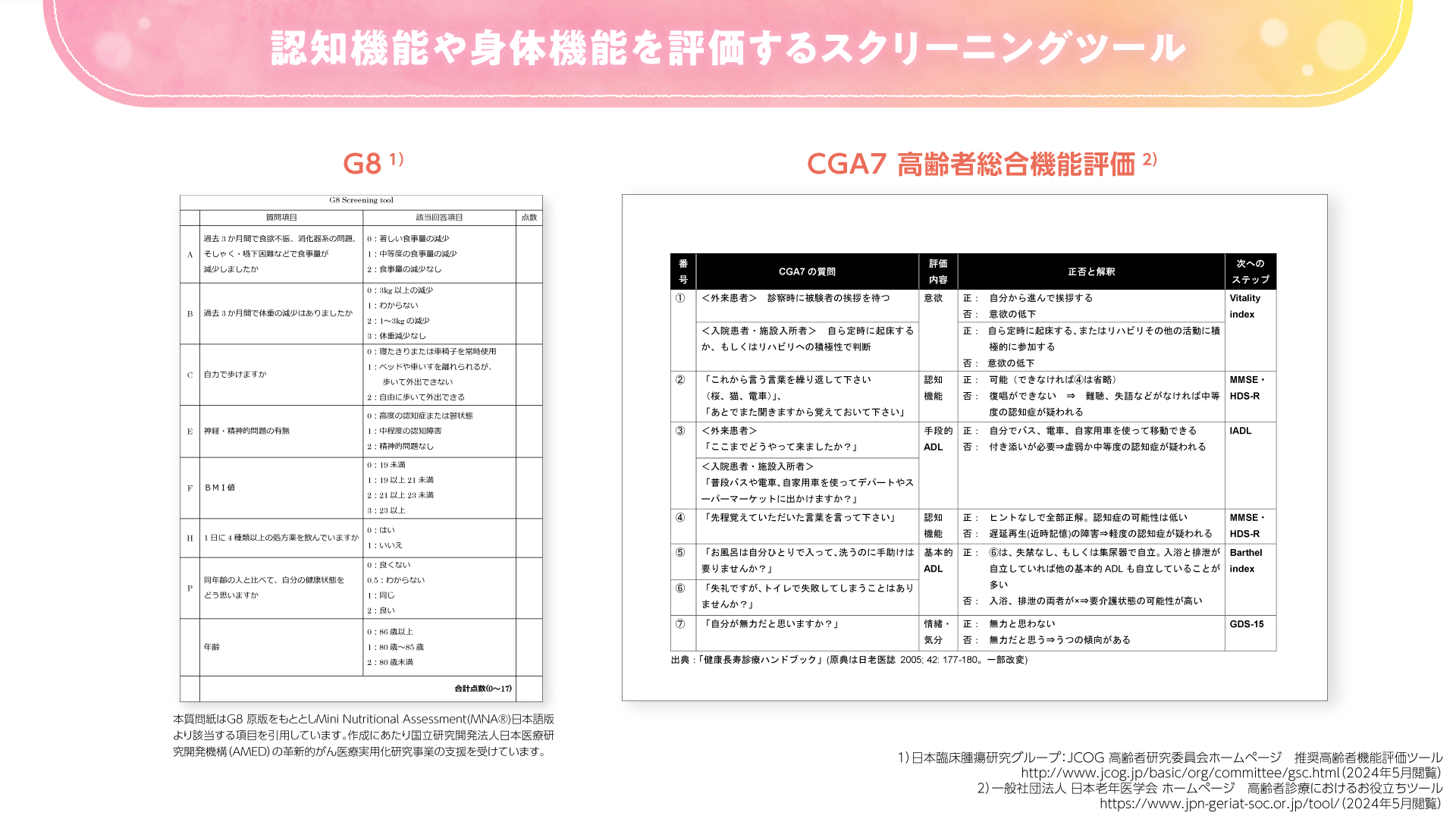
図1
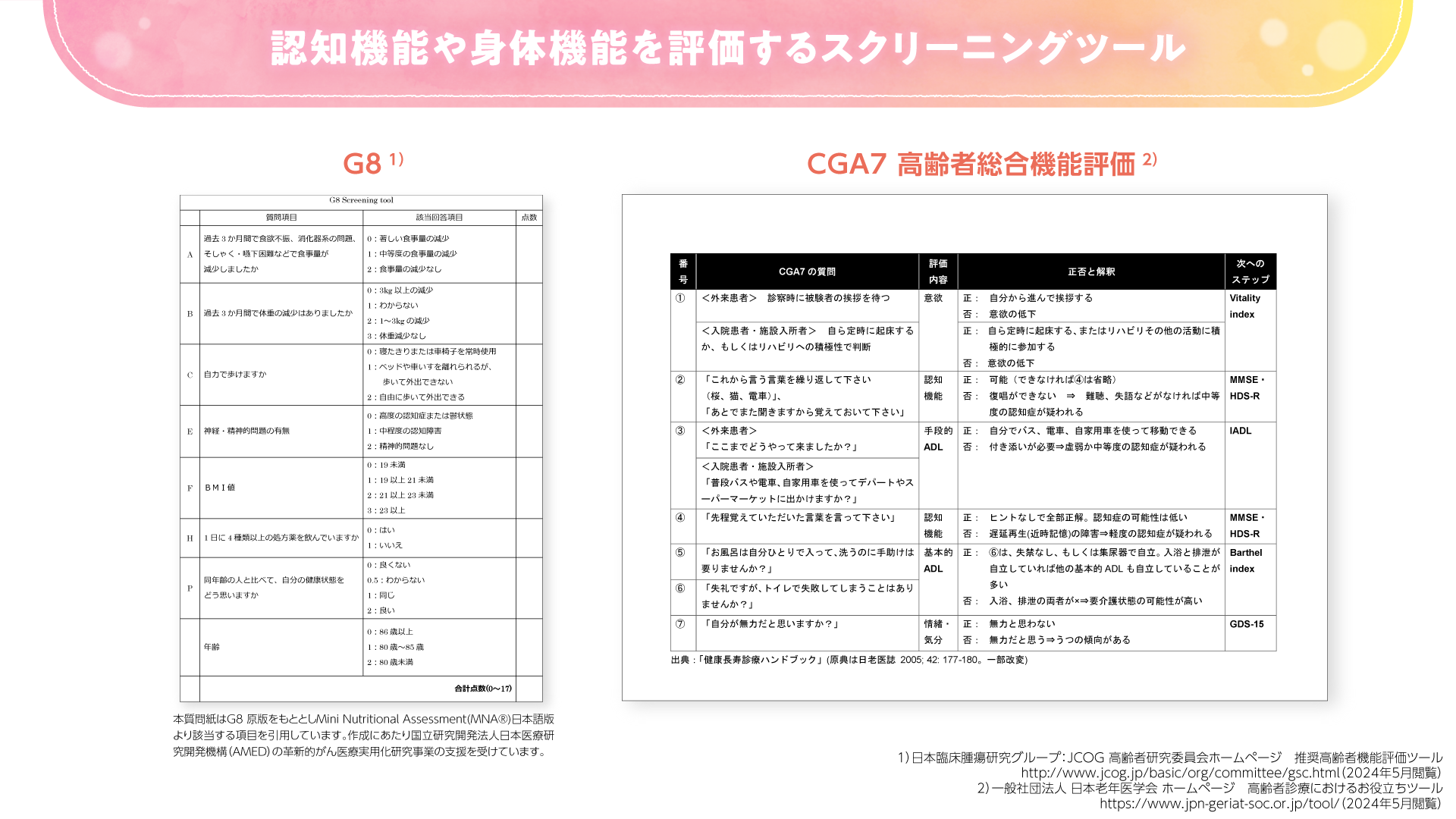
図1
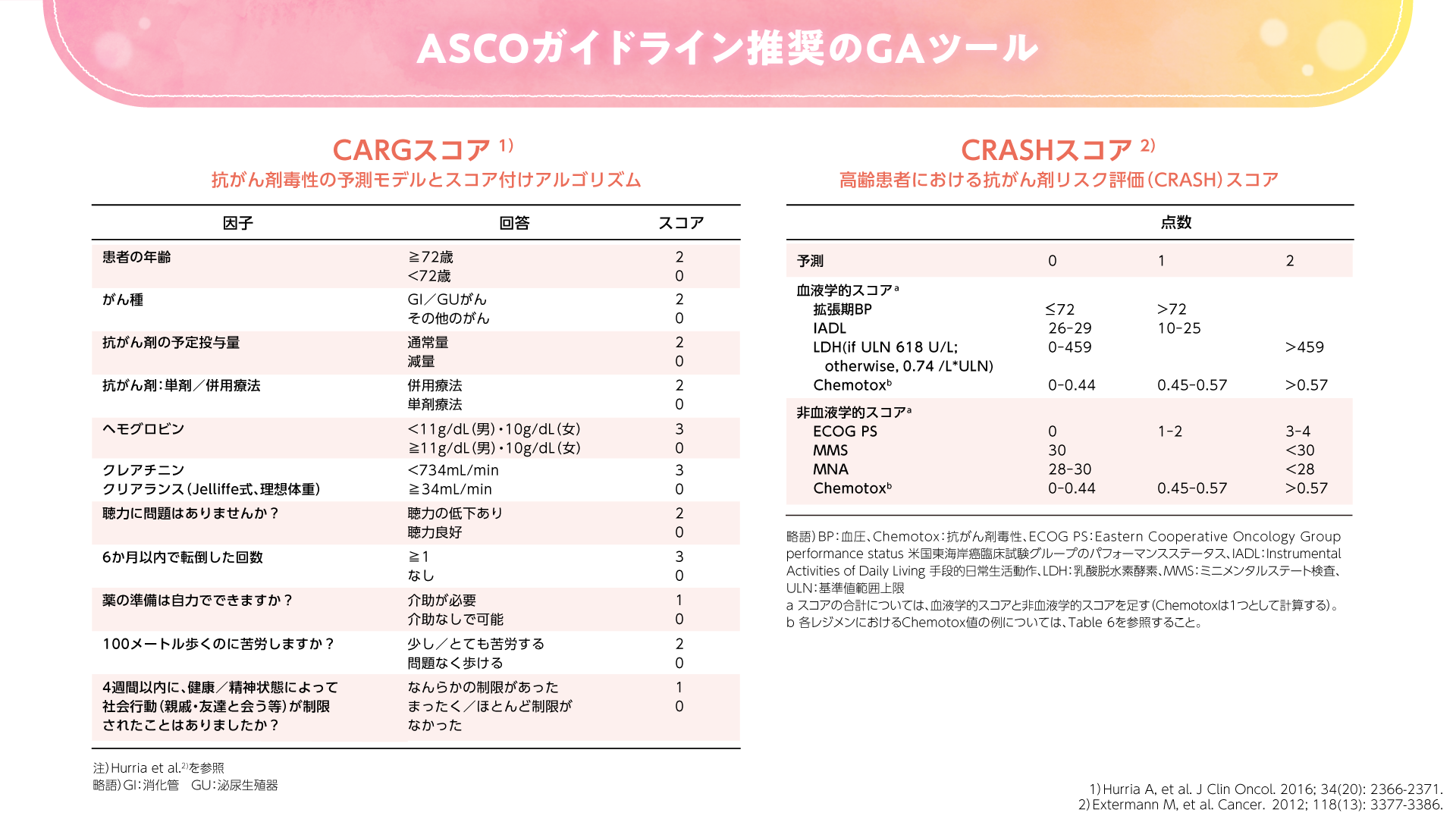
図2
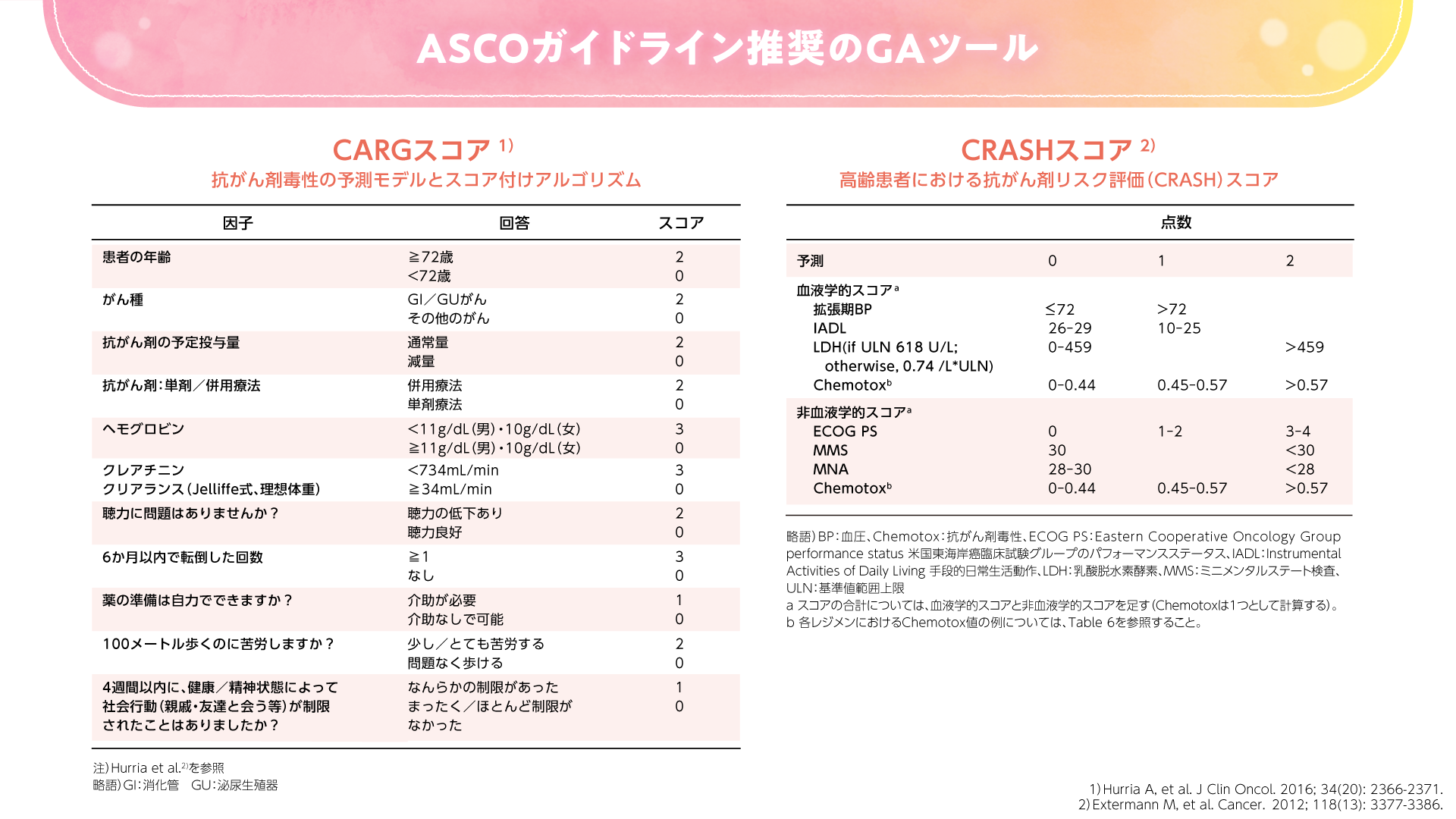
図2
高齢者で注意すべき有害事象のグレードについて、 どのように考えられますか?
<治療経過中のフォローアップのために重要なポイント>
高齢者の場合、軽度の有害事象であっても日常生活の維持が難しくなるようなケースも起こりえます。したがって、軽度の有害事象にも注意する必要があり、発現時にはすぐに発見・対応できるようにあらかじめ体制を整えておくことが重要です。
具体的には、認知機能に問題のない患者さんでは少しの変化でも必ず報告するように伝える、ひとり暮らしの患者さんの場合には必ずソーシャルワーカーに介入してもらうことを化学療法実施の前提とする、などの対策が考えられます。
現在、高齢癌患者さんに対するGAは 国内外でどのような位置づけになっていると思いますか?
<国内外のガイドラインと近年のエビデンス>
国内では、日本臨床腫瘍学会/日本癌治療学会からの高齢者のがん薬物療法ガイドラインで、「高齢がん患者において、がん薬物療法の適応を判断する方法として、高齢者機能評価を実施することを提案する」とされています。
海外では、2018年に発表されたASCOガイドラインで、化学療法を受ける65歳以上の癌患者では、GAにより身体機能、転倒、併存疾患、うつ病、栄養状態、認知機能を評価し、日常的に捉えられていない脆弱性あるいは老年医学的な問題を特定することが推奨されています。
なお、近年は、こうしたGA実施に関する新たなエビデンスが複数報告されています。
2020年にJAMA Oncologyに投稿された高齢の進行癌患者さんを対象とした米国のランダム化比較試験では、GAが患者さんとその介護者の満足度およびコミュニケーションを向上したことが示されました(図3,4)3)。
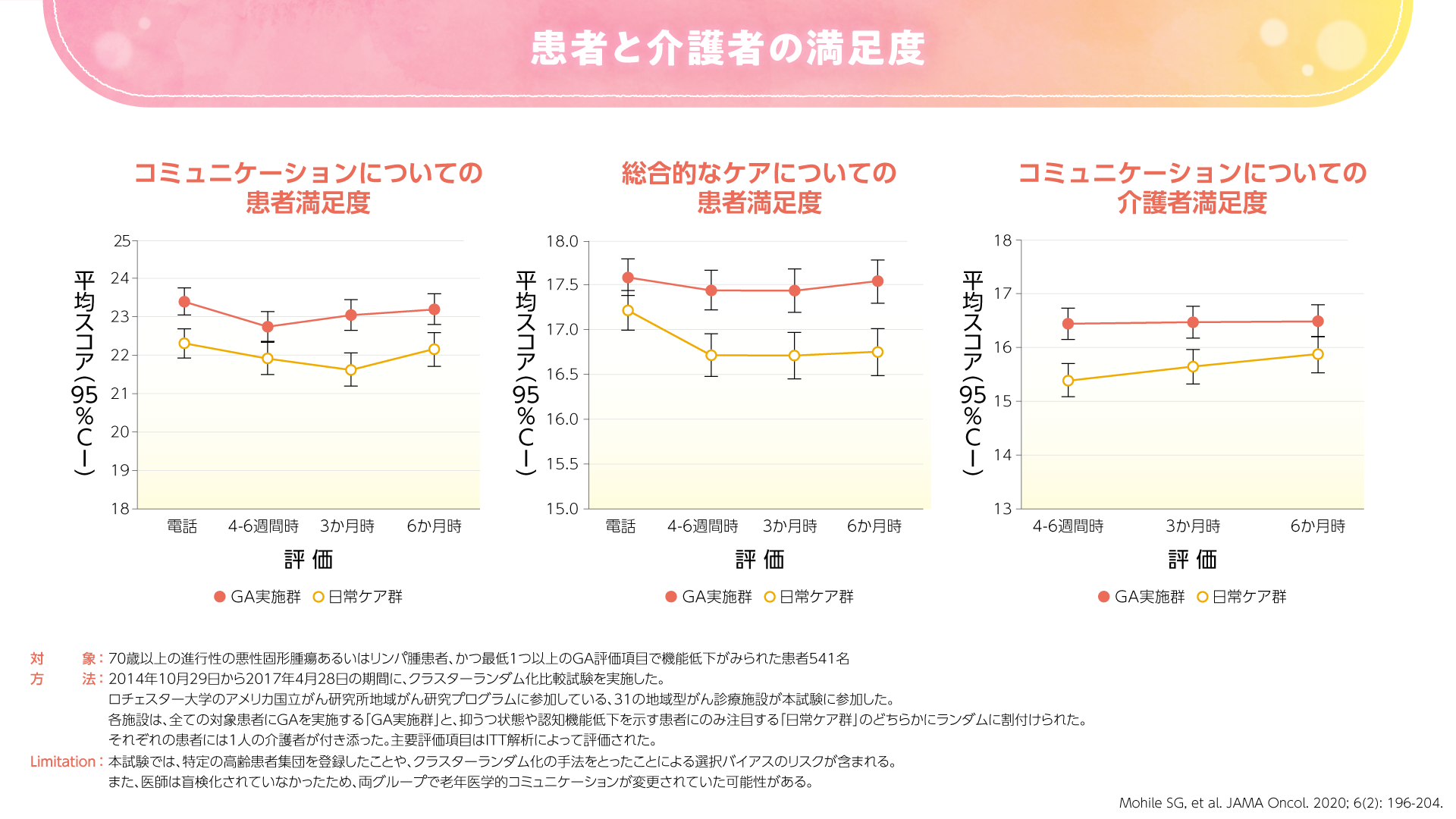
図3
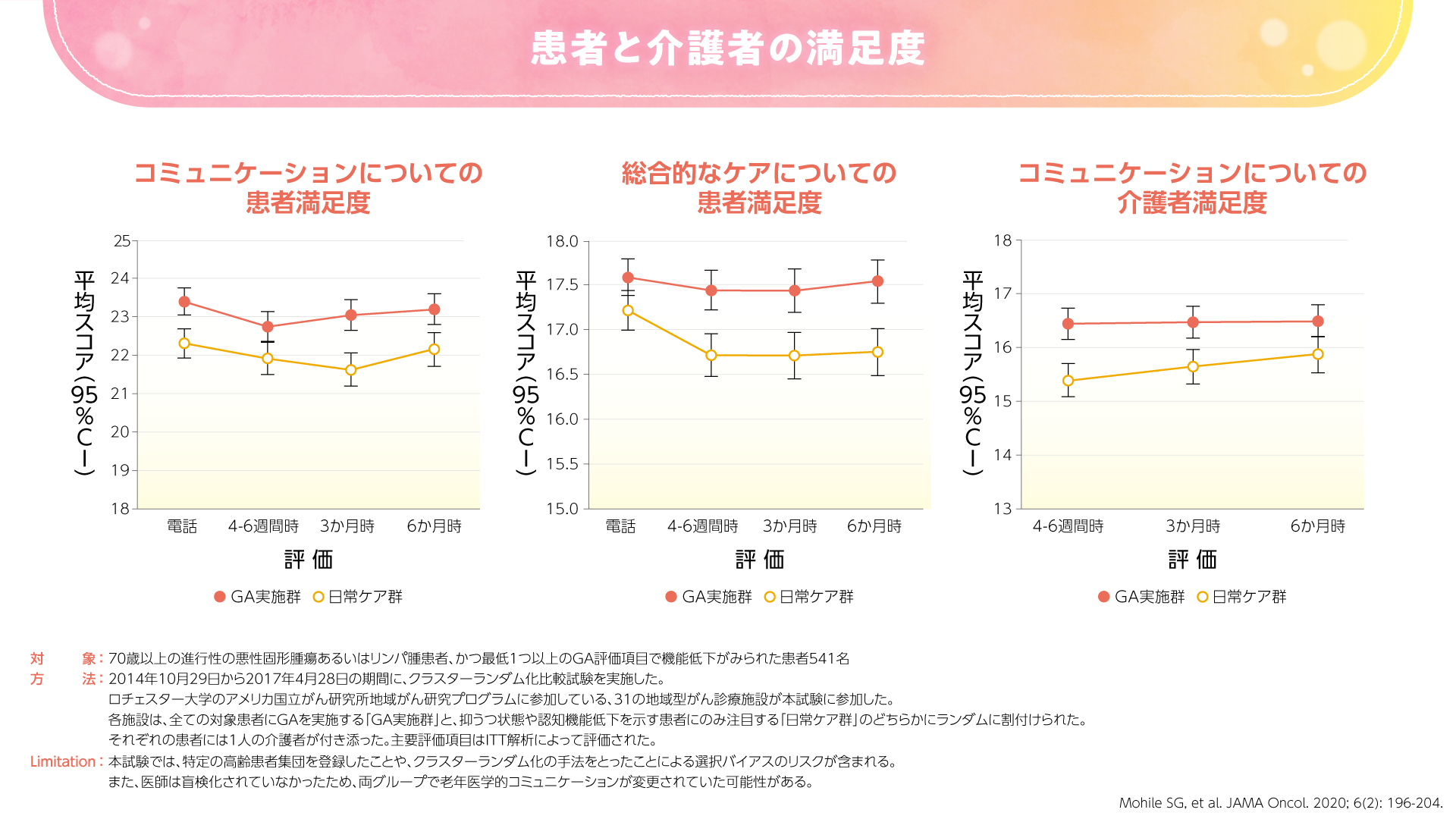
図3
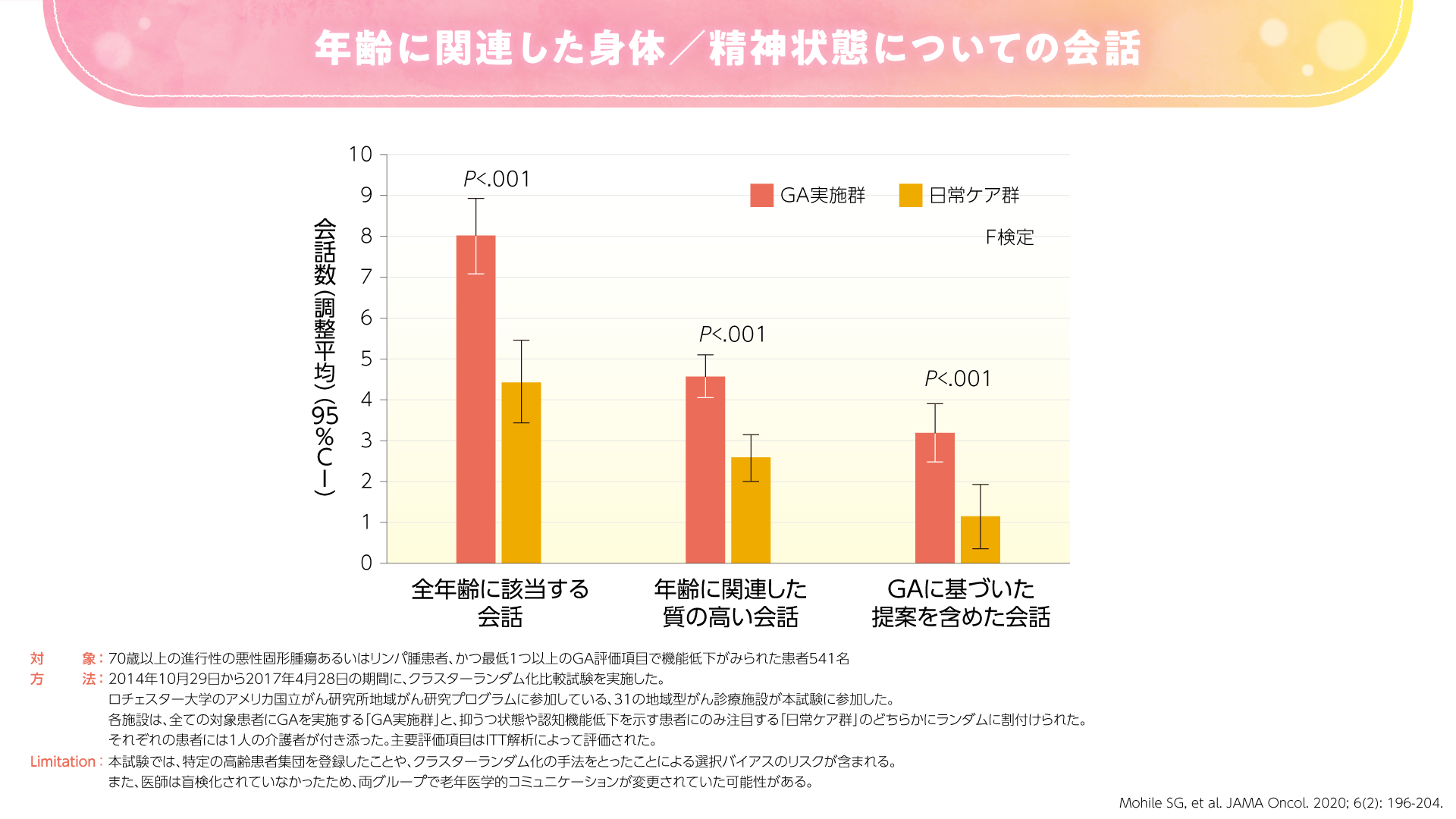
図4
GAによるコミュニケーションの改善は、評価項目の中に老年医学的な質問が含まれていることによるものと考えられます。すなわち、GAの結果を共有する中で、必然的に老年医学的コミュニケーションが増加することが期待されます。例えば、「薬を7種類も飲んでいるんですね。少し整理した方がいいですね」、「2回も転倒したことがあるのなら、おうちの整備をした方がいいですね」などの会話につながることが期待されます。
また、2021年にLancetに投稿された米国のランダム化比較試験では、GA実施群で日常ケア群に比べて重篤な有害事象が少なかったことが示されました4)。本試験では、GA実施群でCTCAEにおけるグレード3-5の毒性発現が51%と、日常ケア群の71%に比べて有意に低い割合でした(p=0.0001、χ2検定)(図5)。GA実施群では日常ケア群に比べて治療強度の低下(一次投与量の減量)が認められ、GAが治療決定に影響したことが示唆されました。一方で、GA実施群の治療強度の低下は有効性を損なうことはなく、6ヵ月および1年時点で両群に生存率の差は認められませんでした(図6)。
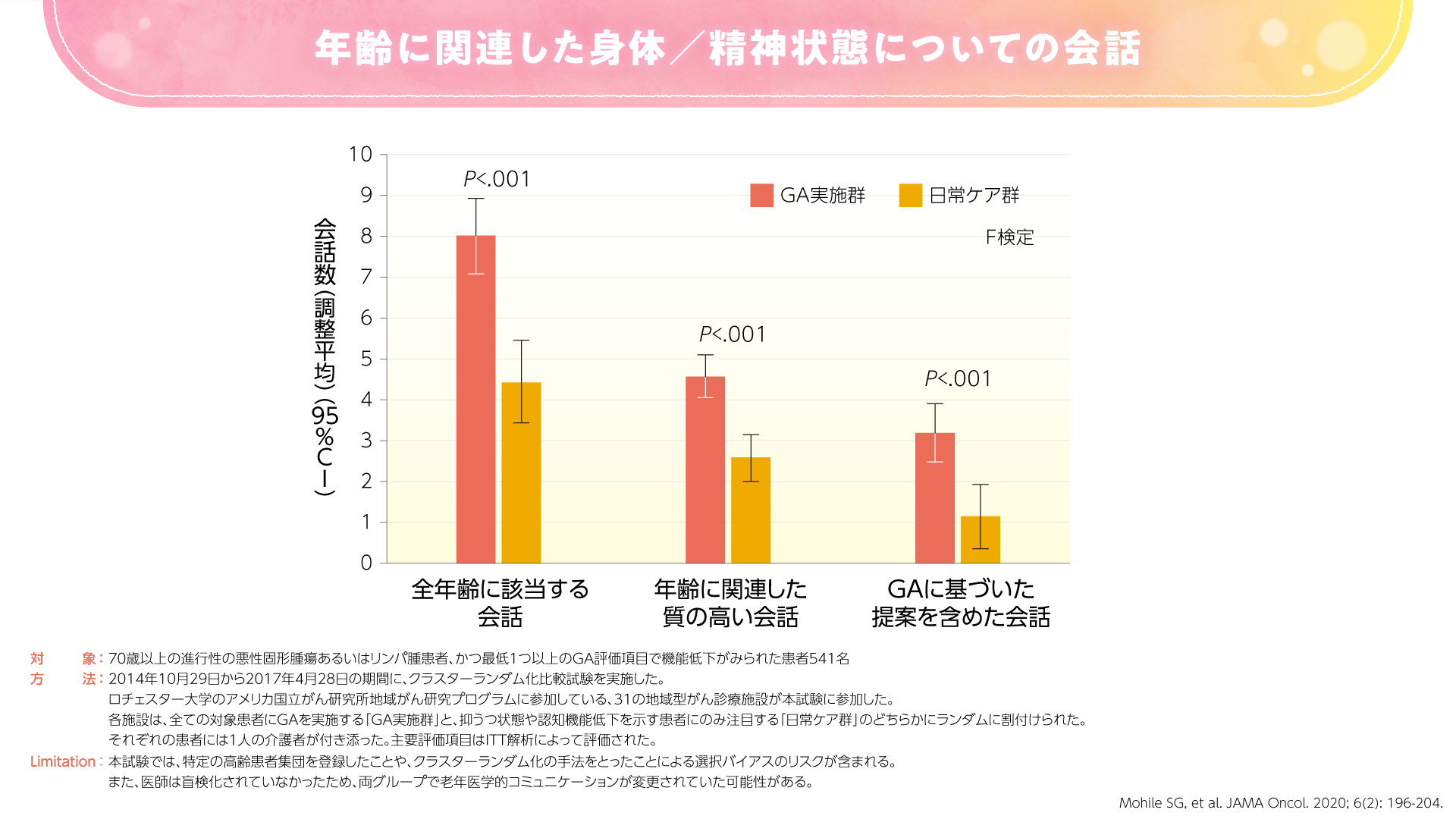
図4
GAによるコミュニケーションの改善は、評価項目の中に老年医学的な質問が含まれていることによるものと考えられます。すなわち、GAの結果を共有する中で、必然的に老年医学的コミュニケーションが増加することが期待されます。例えば、「薬を7種類も飲んでいるんですね。少し整理した方がいいですね」、「2回も転倒したことがあるのなら、おうちの整備をした方がいいですね」などの会話につながることが期待されます。
また、2021年にLancetに投稿された米国のランダム化比較試験では、GA実施群で日常ケア群に比べて重篤な有害事象が少なかったことが示されました4)。本試験では、GA実施群でCTCAEにおけるグレード3-5の毒性発現が51%と、日常ケア群の71%に比べて有意に低い割合でした(p=0.0001、χ2検定)(図5)。GA実施群では日常ケア群に比べて治療強度の低下(一次投与量の減量)が認められ、GAが治療決定に影響したことが示唆されました。一方で、GA実施群の治療強度の低下は有効性を損なうことはなく、6ヵ月および1年時点で両群に生存率の差は認められませんでした(図6)。
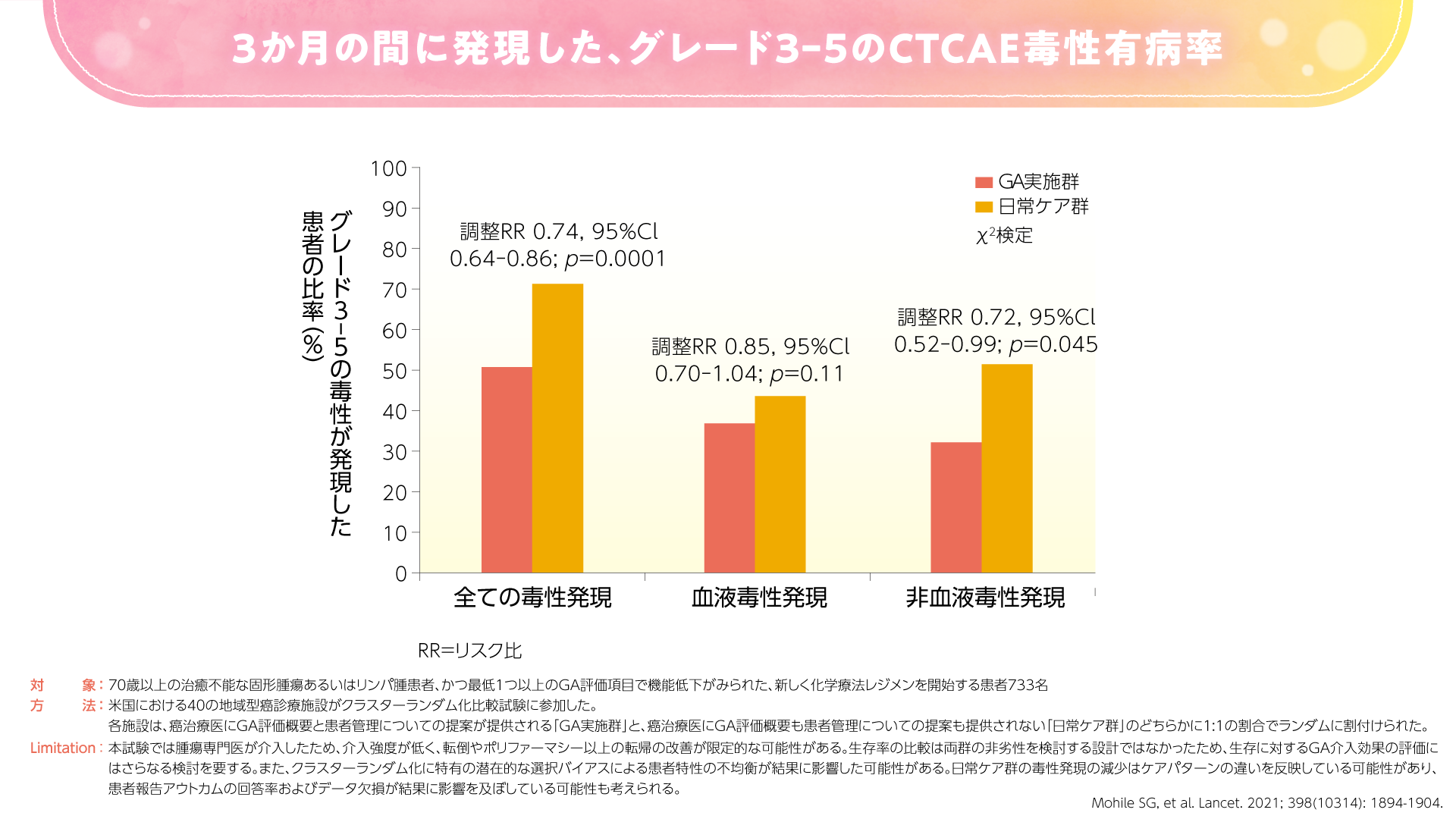
図5
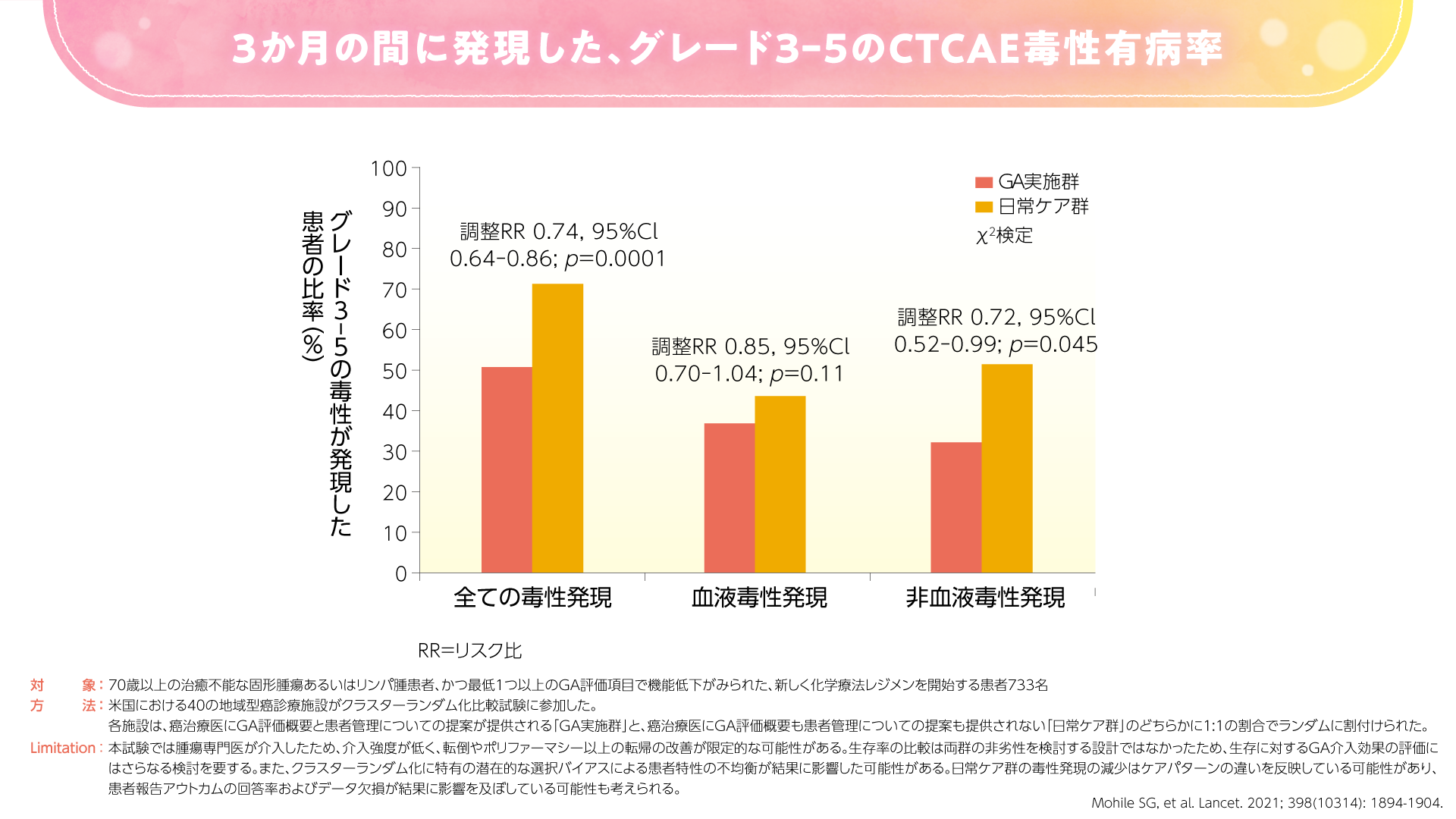
図5
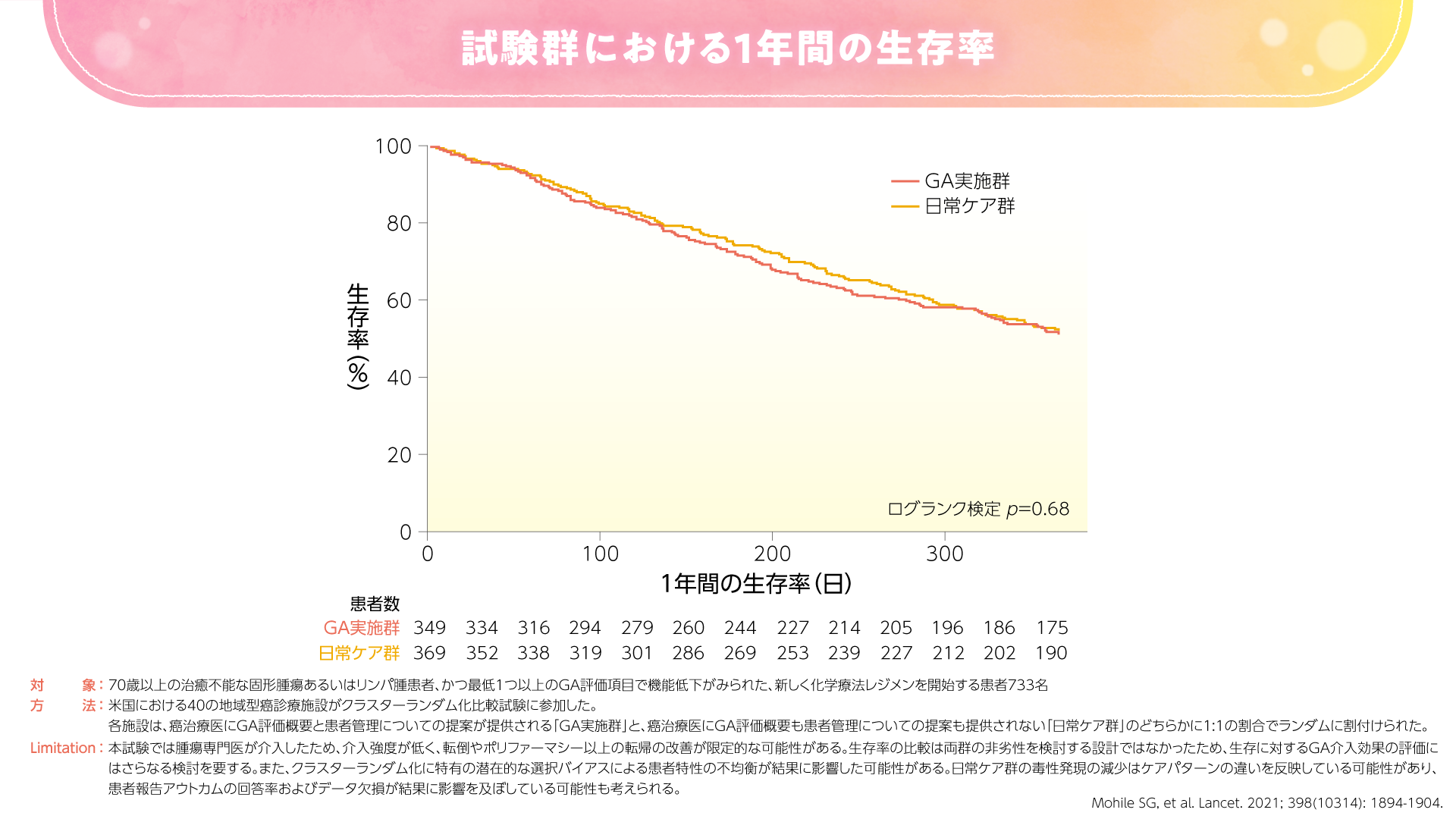
図6
多様な背景を有する高齢者では、暦年齢やPSのみで適切な治療選択肢を判断するのは難しいと考えられます。そのような場合に、目に見えない情報を総合的に評価するための方法として高齢者機能評価(GA)が有用です。
日常診療で実施可能な高齢患者さん用の評価ツールをぜひご活用ください。
■引用
1)全国がん罹患データ(2016年~2020年):国立がん研究センターがん情報サービス「がん統計」(全国がん登録)
2)日本肺癌学会編:肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む 2024年版
URL:https://www.haigan.gr.jp/publication/guideline/examination/2024/1/2/240102070100.html#cq65
3)Mohile SG, et al. JAMA Oncol. 2020; 6(2): 196-204.
4)Mohile SG, et al. Lancet. 2021; 398(10314): 1894-1904.
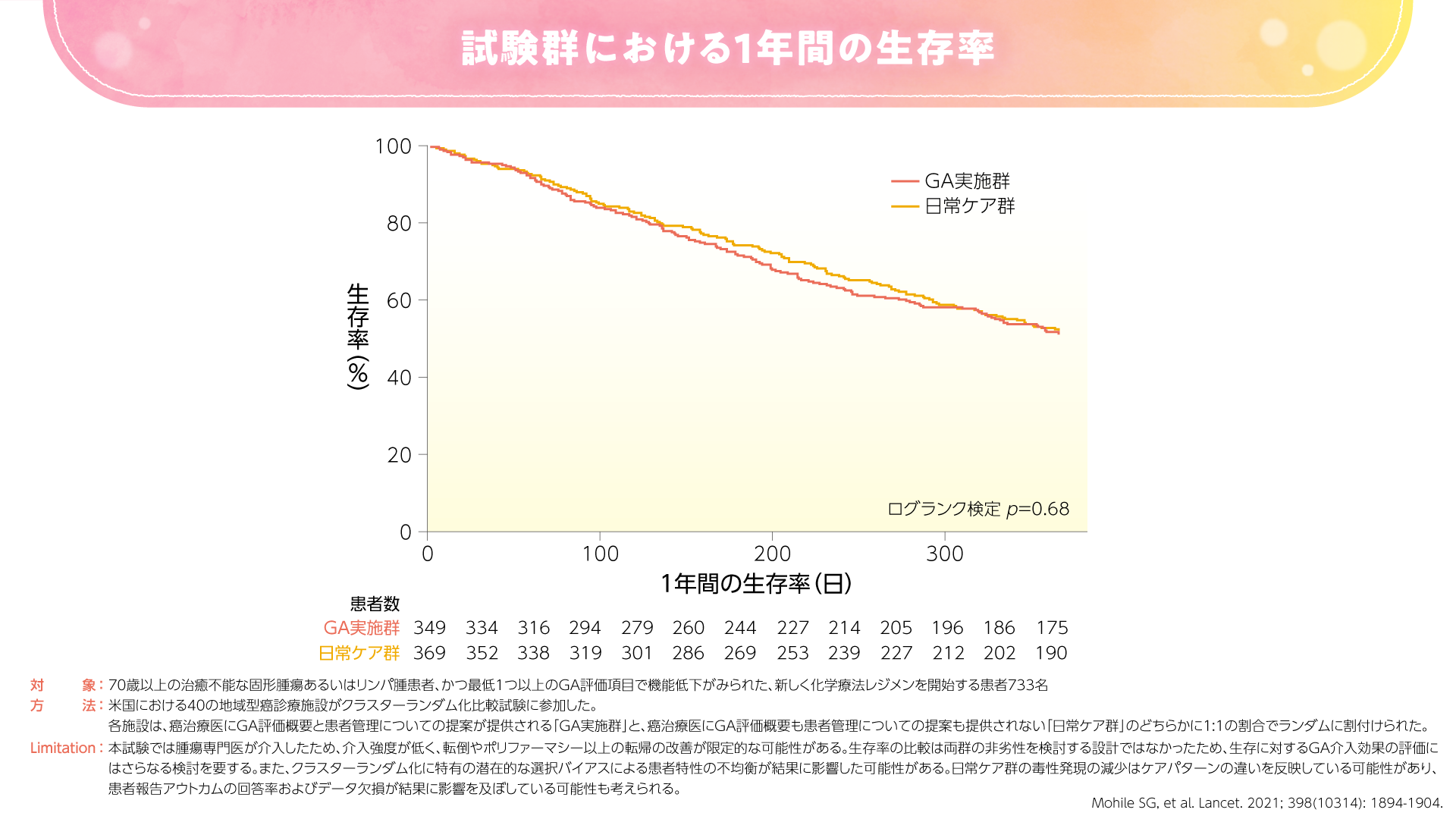
図6
多様な背景を有する高齢者では、暦年齢やPSのみで適切な治療選択肢を判断するのは難しいと考えられます。そのような場合に、目に見えない情報を総合的に評価するための方法として高齢者機能評価(GA)が有用です。
日常診療で実施可能な高齢患者さん用の評価ツールをぜひご活用ください。
■引用
1)全国がん罹患データ(2016年~2020年):国立がん研究センターがん情報サービス「がん統計」(全国がん登録)
2)日本肺癌学会編:肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む 2024年版
URL:https://www.haigan.gr.jp/publication/guideline/examination/2024/1/2/240102070100.html#cq65
3)Mohile SG, et al. JAMA Oncol. 2020; 6(2): 196-204.
4)Mohile SG, et al. Lancet. 2021; 398(10314): 1894-1904.