アドセトリス点滴静注用50mg 発売中
末梢性T細胞リンパ腫


臨床成績
「警告・禁忌を含む使⽤上の注意」につきましては、「電子添文」をご参照ください。
再発⼜は難治性のCD30陽性の⾮ホジキンリンパ腫※患者を対象とした試験
(海外第Ⅱ相試験:SGN35-012試験)
ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
Horwitz SM, et al. : Blood. 2014; 123(20): 3095-3100.
本試験は、Seattle Genetics 社(現・Seagen 社)の資⾦提供により実施された。
本論⽂の著者のうち1名は同社の社員で、試験計画、解析、執筆等の⽀援を受けている。
著者に同社より研究資⾦、謝礼⾦等を受領している者が含まれる。
※ SGN35-012試験の対象疾患である⾮ホジキンリンパ腫のうちパートAに含まれたT細胞リンパ腫を末梢性T細胞リンパ腫(PTCL)と同義としている
試験概要を確認する
試験概要
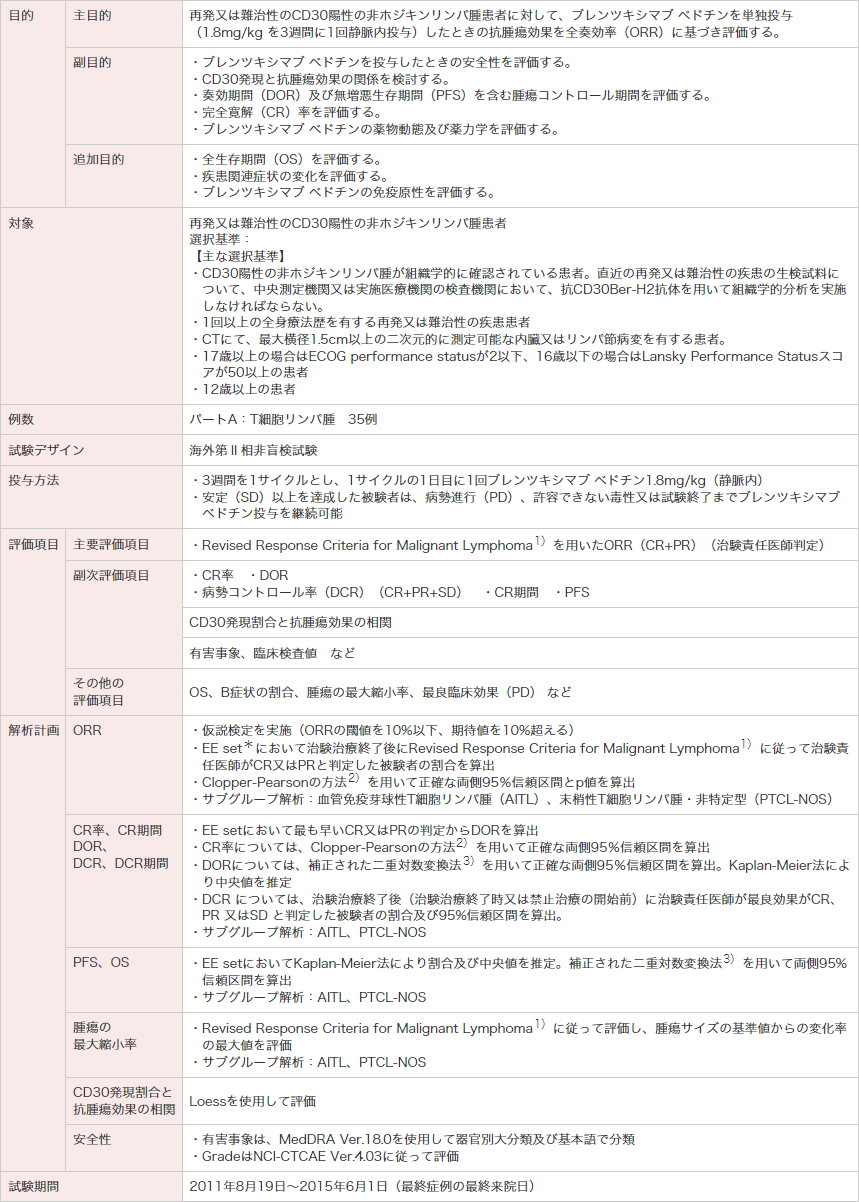
PR:部分寛解。ECOG:米国東海岸がん臨床試験グループ。
* EE set(有効性評価可能解析対象集団)は、ブレンツキシマブ ベドチンを1回以上投与され、かつ試験終了又は新たな抗腫瘍治療を開始するまでにベースラインの腫瘍評価及び1時点以上の投与後腫瘍評価を有する被験者を含む。
1)Cheson BD, et al. : J Clin Oncol. 2007; 25(5): 579-586.
2)Clopper CJ, Pearson ES. : Biometrika. 1934; 26(4): 404-413.
3)Collett D. Modelling survival data in medical research. London, Chapman & Hall. 1994; 237-251.
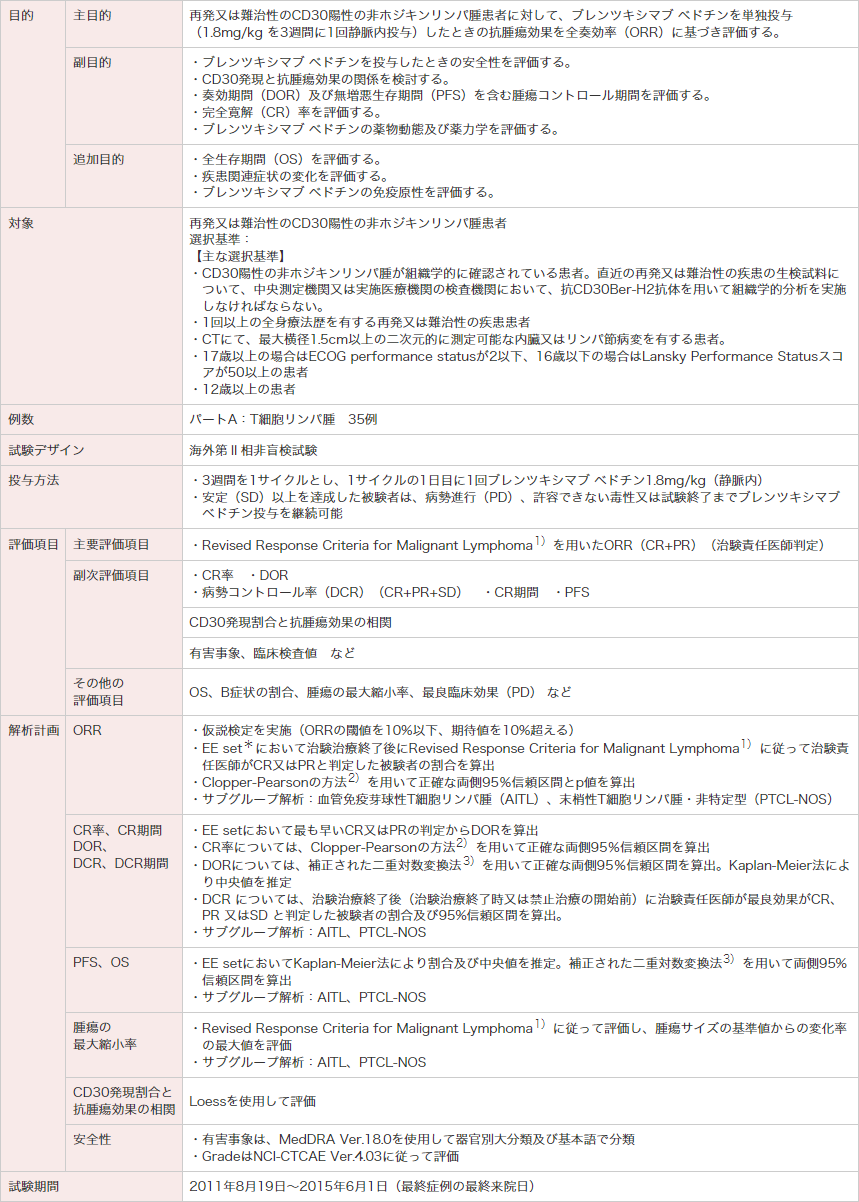
PR:部分寛解。ECOG:米国東海岸がん臨床試験グループ。
* EE set(有効性評価可能解析対象集団)は、ブレンツキシマブ ベドチンを1回以上投与され、かつ試験終了又は新たな抗腫瘍治療を開始するまでにベースラインの腫瘍評価及び1時点以上の投与後腫瘍評価を有する被験者を含む。
1)Cheson BD, et al. : J Clin Oncol. 2007; 25(5): 579-586.
2)Clopper CJ, Pearson ES. : Biometrika. 1934; 26(4): 404-413.
3)Collett D. Modelling survival data in medical research. London, Chapman & Hall. 1994; 237-251.
試験結果を確認する
患者背景(安全性解析対象集団)
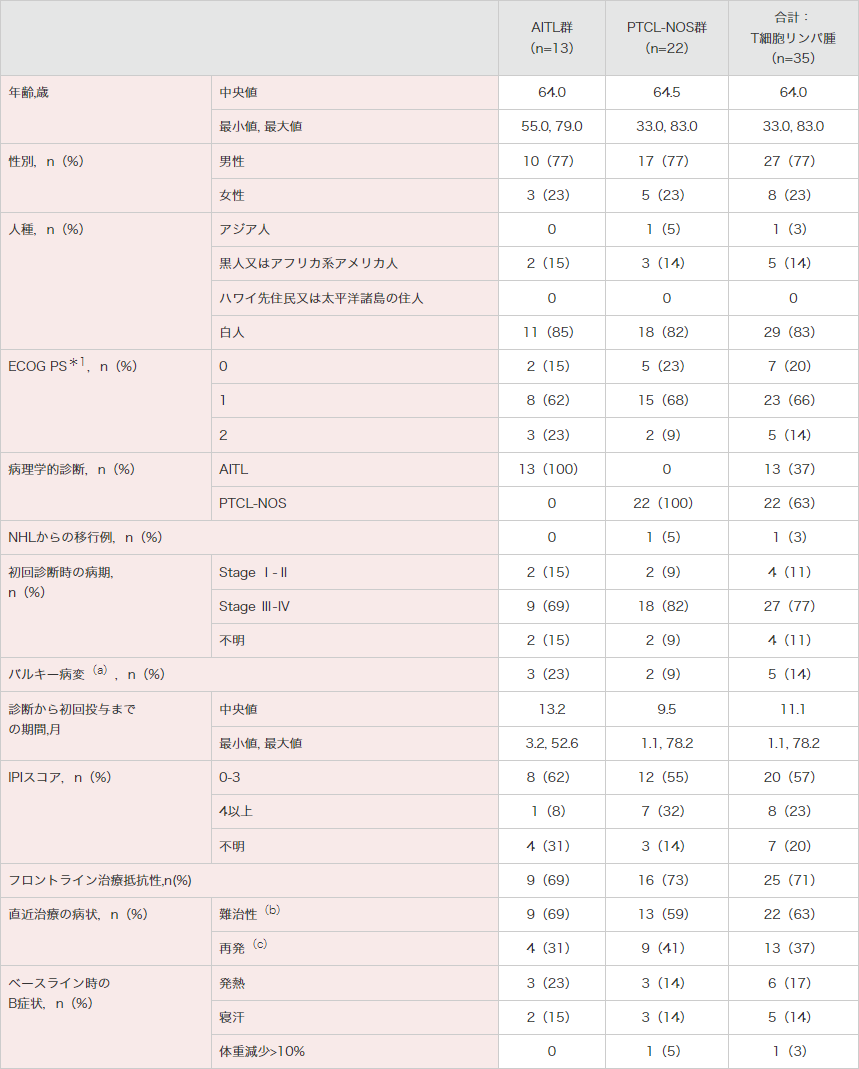
ECOG PS:米国東海岸がん臨床試験グループのパフォーマンスステータス。NHL:非ホジキンリンパ腫。IPI:国際予後指標。
(a) ≥5 cmのベースライン指標病変が1つ以上。
(b) 難治性:前治療が1つのみの場合は、直近治療の最良奏効がPR、SD、PDのいずれかであるか、その治療でCRとなった後、治療完了の3ヵ月以内に再発。前治療が2つ以上の場合は、直近治療の最良奏効がSDかPDである。
(c) 再発:前治療が1つのみの場合は、CR後、直近治療の完了後3ヵ月超以降に再発。前治療が2つ以上の場合は、直近治療の最良奏効がCR又はPRである。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり;0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
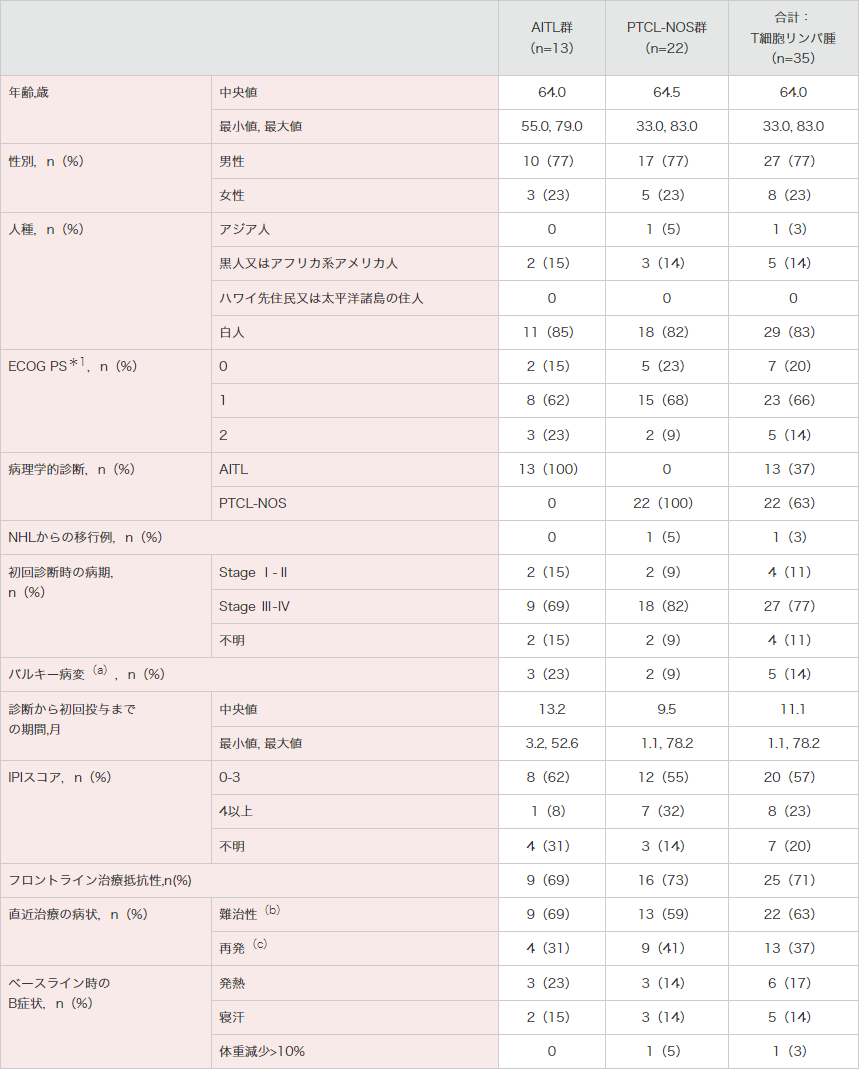
ECOG PS:米国東海岸がん臨床試験グループのパフォーマンスステータス。NHL:非ホジキンリンパ腫。IPI:国際予後指標。
(a) ≥5 cmのベースライン指標病変が1つ以上。
(b) 難治性:前治療が1つのみの場合は、直近治療の最良奏効がPR、SD、PDのいずれかであるか、その治療でCRとなった後、治療完了の3ヵ月以内に再発。前治療が2つ以上の場合は、直近治療の最良奏効がSDかPDである。
(c) 再発:前治療が1つのみの場合は、CR後、直近治療の完了後3ヵ月超以降に再発。前治療が2つ以上の場合は、直近治療の最良奏効がCR又はPRである。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり;0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
ORR(治験責任医師判定)[主要評価項目及びそのサブグループ解析]
T細胞リンパ腫被験者34例における主要評価項目である治験責任医師判定に基づくORR(CR+PR)は41%(95%信頼区間:24.6, 59.3)であり、95%信頼区間の下限である24.6%が事前に設定した閾値である10%を超えました(p<0.001、Clopper-Pearson検定)。AITLサブグループのORRは54%(95%信頼区間:25.1, 80.8)、PTCL-NOSサブグループのORRは33%(95%信頼区間:14.6, 57)でした。
腫瘍の縮小は判定が可能であった29例中23例に認められました(T細胞リンパ腫被験者34例中5例は、ベースライン後の画像評価がありませんでした。これら5例はいずれも臨床的PDと判定)。
● T細胞リンパ腫被験者に対するORR、最良臨床効果、DCR(有効性評価可能解析対象集団)
(治験責任医師判定)[主要評価項目(a)][副次評価項目(b)][その他の評価項目(c)]
[サブグループ解析]
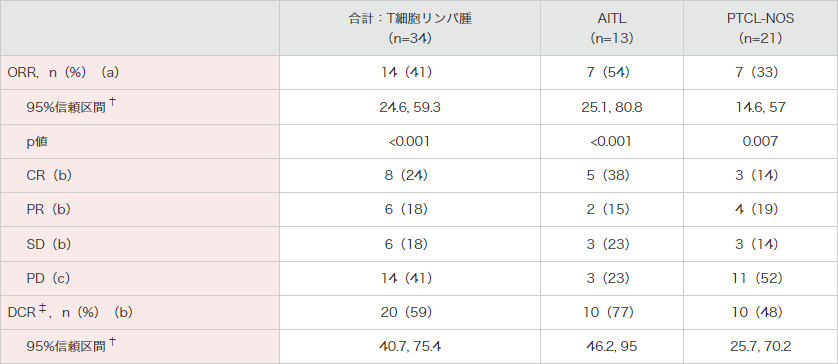
† Clopper-Pearsonの方法2)を用いて両側95%正確信頼区間及び両側p値を算出した。
‡ CR + PR + SD。
2)Clopper CJ, Pearson ES. : Biometrika. 1934; 26(4): 404-413.
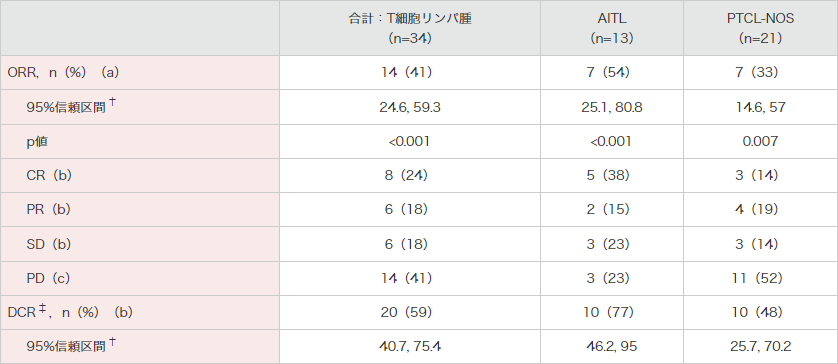
† Clopper-Pearsonの方法2)を用いて両側95%正確信頼区間及び両側p値を算出した。
‡ CR + PR + SD。
2)Clopper CJ, Pearson ES. : Biometrika. 1934; 26(4): 404-413.
● 腫瘍の最大縮小率(有効性評価可能解析対象集団)[その他の評価項目][サブグループ解析]
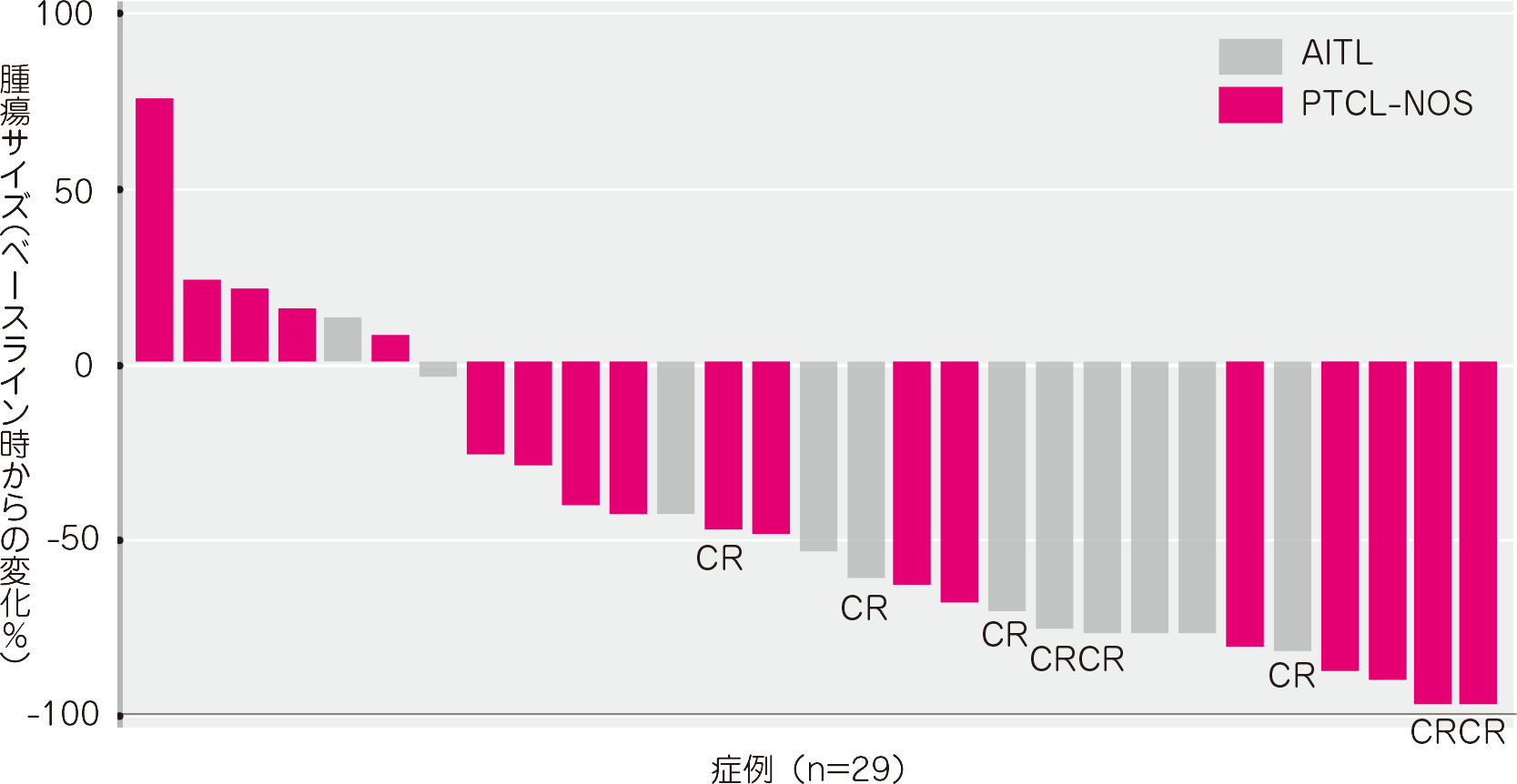
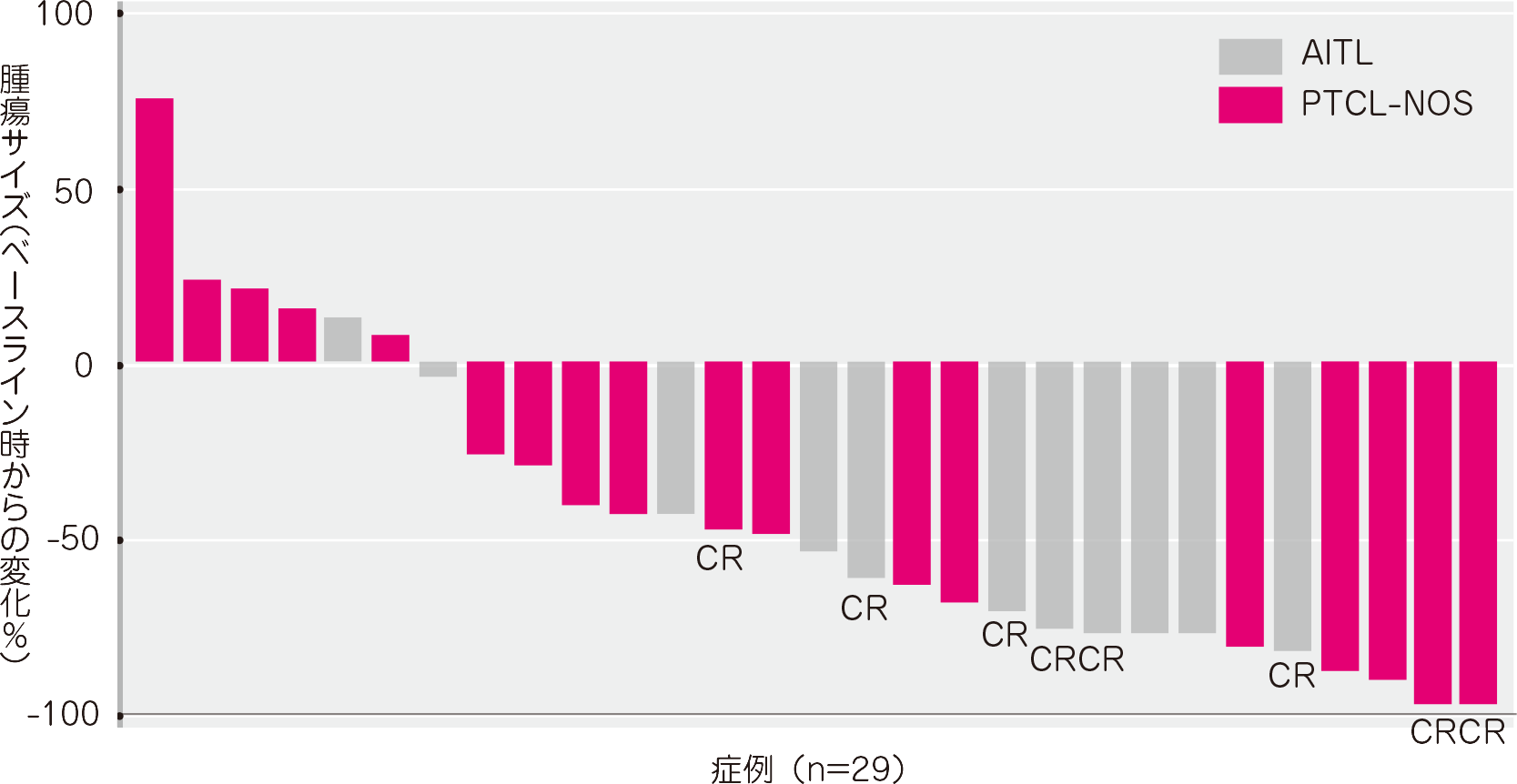
DOR(有効性評価可能解析対象集団)[副次評価項目及びそのサブグループ解析]
DORの推定中央値は、T細胞リンパ腫被験者全体(14例)で7.6ヵ月(95%信頼区間: 1.4, −、範囲: 1.3~36.1+ヵ月)、AITLサブグループ(7例)で10.9ヵ月(95%信頼区間: 1.4, −、範囲: 1.3~36.1+ヵ月)、PTCL-NOSサブグループ(7例)で7.6ヵ月(95%信頼区間: 1.4, −、範囲: 1.4~30.3+ヵ月)でした。
CR期間(有効性評価可能解析対象集団)[副次評価項目及びそのサブグループ解析]
試験終了時点では、T細胞リンパ腫被験者全体(8例、範囲: 1.8+~36.1+ヵ月)、AITLサブグループ(5例、範囲: 1.8+~36.1+ヵ月)又はPTCL-NOSサブグループ(3例、範囲: 7.6~30.3+ヵ月)のいずれにおいても、CR期間の推定中央値は未到達でした。
PFS[副次評価項目及びそのサブグループ解析]
T細胞リンパ腫被験者では、27例(79%)にPD又は死亡が認められました。PFSの推定中央値は、T細胞リンパ腫被験者全体で2.5ヵ月(95%信頼区間: 1.4, 6.1、範囲: 0.3~37.4+ヵ月)、AITLサブグループで6.7ヵ月(95%信頼区間: 1.3, 20.4、範囲: 0.5~37.4+ヵ月)、PTCL-NOSサブグループで1.6ヵ月(95%信頼区間: 1.2, 2.8、範囲: 0.3~31.5+ヵ月)でした。
● T細胞リンパ腫被験者におけるPFS(有効性評価可能解析対象集団)[副次評価項目]
[サブグループ解析]
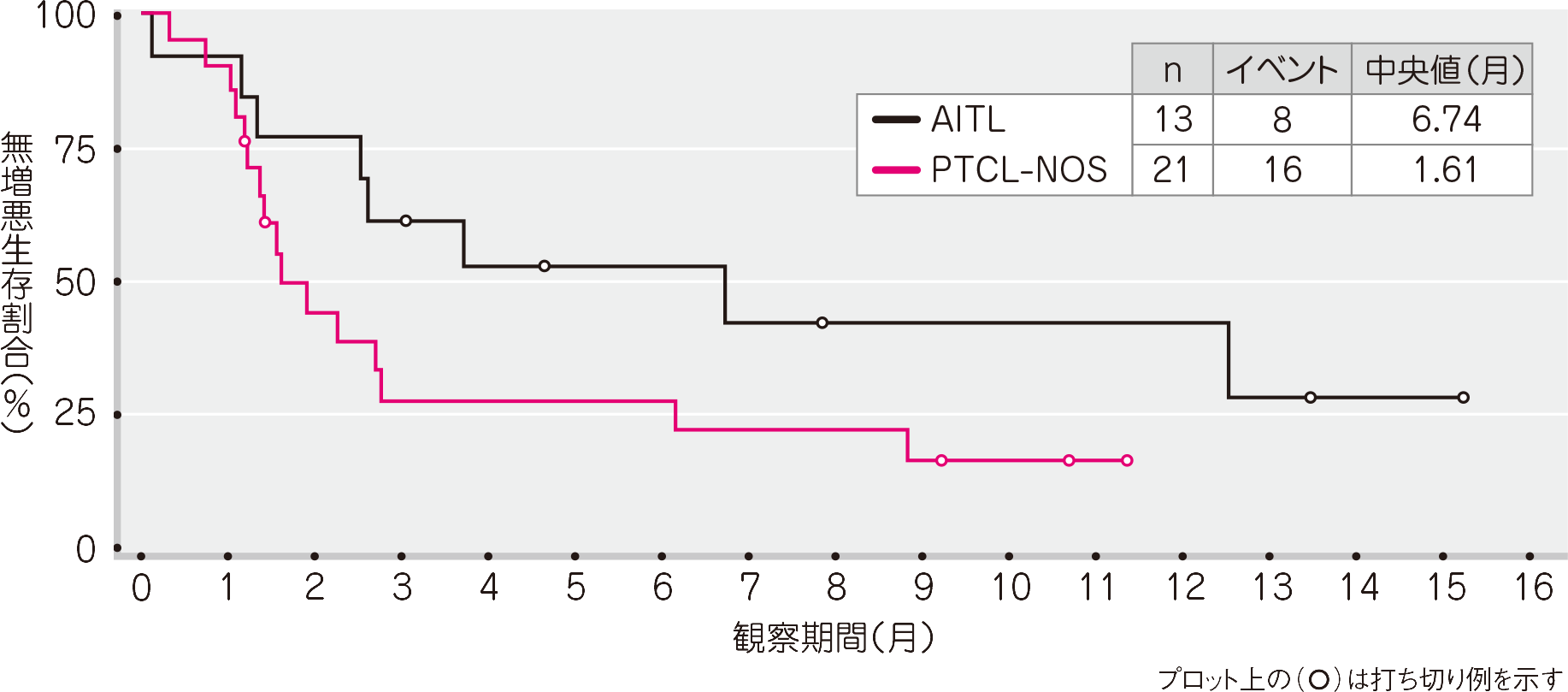
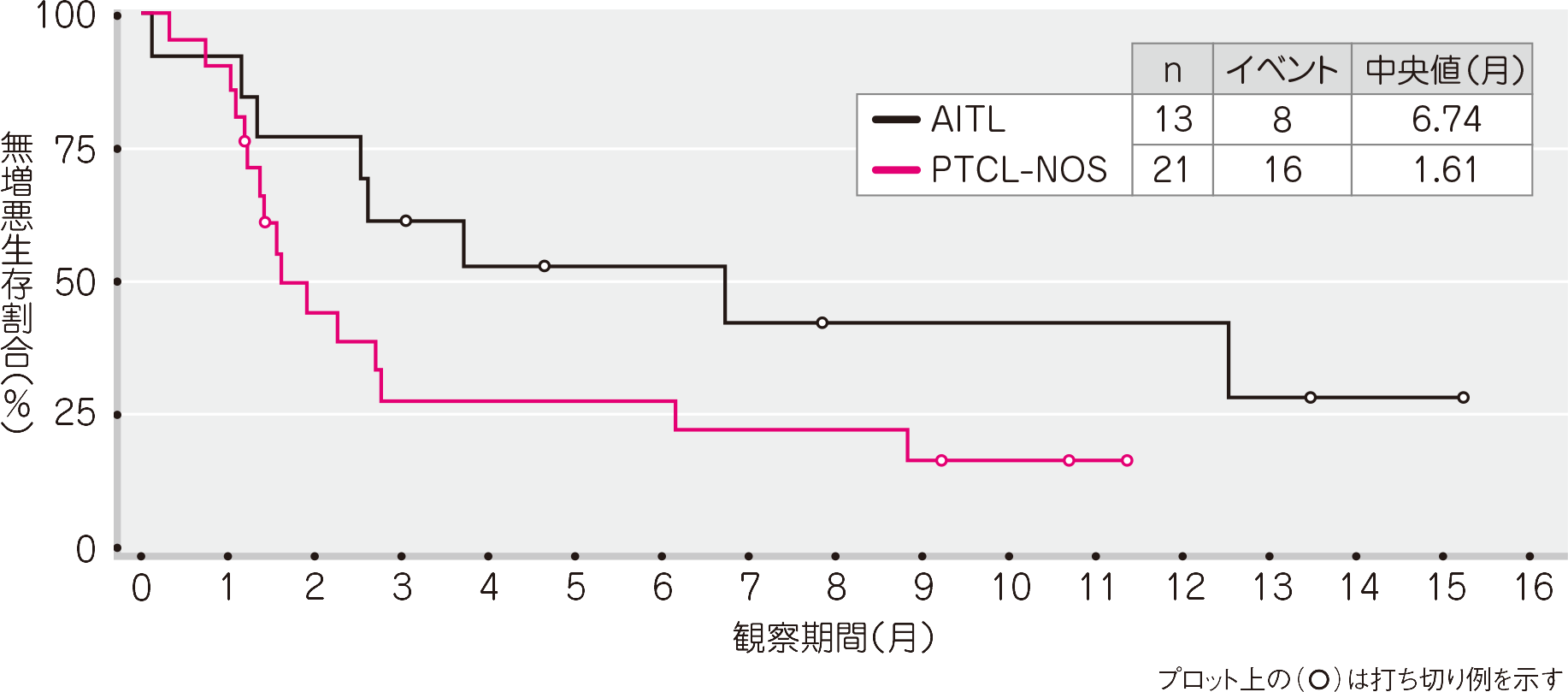
OS(有効性評価可能解析対象集団)[その他の評価項目及びそのサブグループ解析]
T細胞リンパ腫被験者全体で23例(68%)に死亡が認められました。OSの推定中央値は、T細胞リンパ腫被験者全体で18.1ヵ月(95%信頼区間: 6.8, 33.6、範囲: 0.5~39.3+ヵ月)、AITLサブグループで20.1ヵ月(95%信頼区間: 2.5, −、範囲: 0.5~38.4+ヵ月)、PTCL-NOSサブグループで17.0ヵ月(95%信頼区間: 4.3, −、範囲: 1~39.3+ヵ月)でした。
安全性[副次評価項目]
副作用発現頻度は、35例中28例(80%)でした。主な副作用(15%以上)は、末梢性感覚ニューロパチー13例(37%)及び疲労7例(20%)でした。
重篤な有害事象は15例に認められ、下表のとおりでした。
投与中止に至った有害事象は6例でした。有害事象の内訳は、末梢性感覚ニューロパチー3例、ニューモシスチス・イロベチイ肺炎、発熱、敗血症〔以上、各1例〕でした。
治験期間中の死亡例(治験治療薬の最終投与後30日以内に認められた死亡)は、AITL群2例(15%)及びPTCL-NOS群1例(5%)でした。AITL群の1例は原疾患に起因する死亡でしたが、もう1例は原疾患との関連が不明であり、その死因は急性呼吸窮迫症候群でした。PTCL-NOS群の1例は原疾患に起因する死亡でした。
● 海外第Ⅱ相試験(SGN35-012試験)における副作用*(安全性解析対象集団)
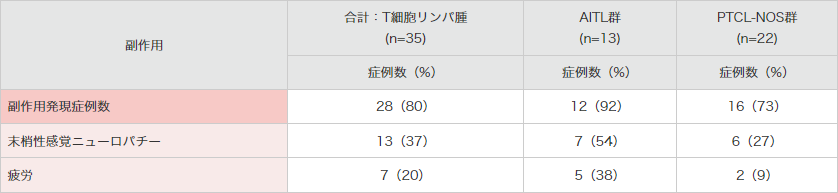
MedDRA Ver.18.0により集計。SGN35-012試験。
*合計:T細胞リンパ腫群で15%以上発現した副作用を示した。
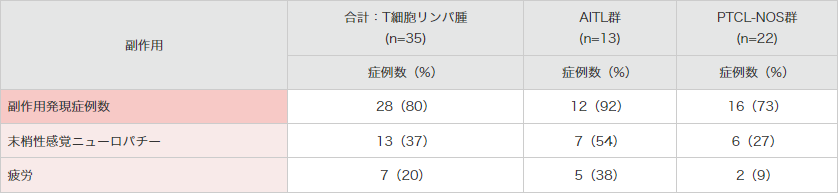
MedDRA Ver.18.0により集計。SGN35-012試験。
*合計:T細胞リンパ腫群で15%以上発現した副作用を示した。
● 海外第Ⅱ相試験(SGN35-012試験)におけるGrade 3以上の有害事象*(安全性解析対象集団)
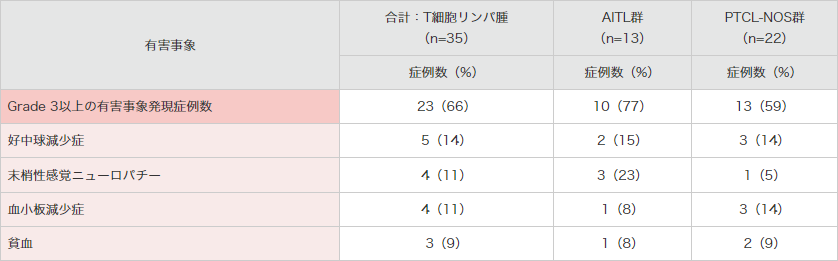
MedDRA Ver18.0、NCI-CTCAE Ver.4.03より集計。SGN35-012試験。
*合計:T細胞リンパ腫群で3例以上発現したGrade 3以上の有害事象を示した。
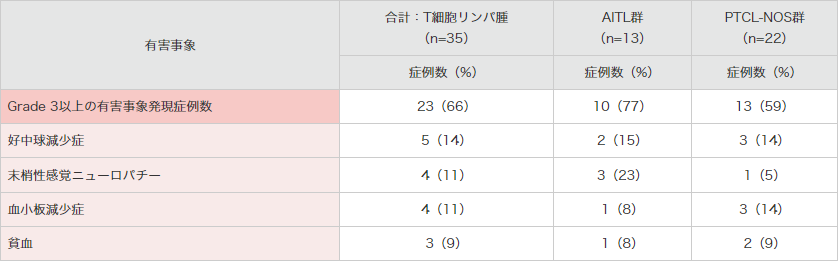
MedDRA Ver18.0、NCI-CTCAE Ver.4.03より集計。SGN35-012試験。
*合計:T細胞リンパ腫群で3例以上発現したGrade 3以上の有害事象を示した。
● 海外第Ⅱ相試験(SGN35-012試験)における重篤な有害事象(安全性解析対象集団)
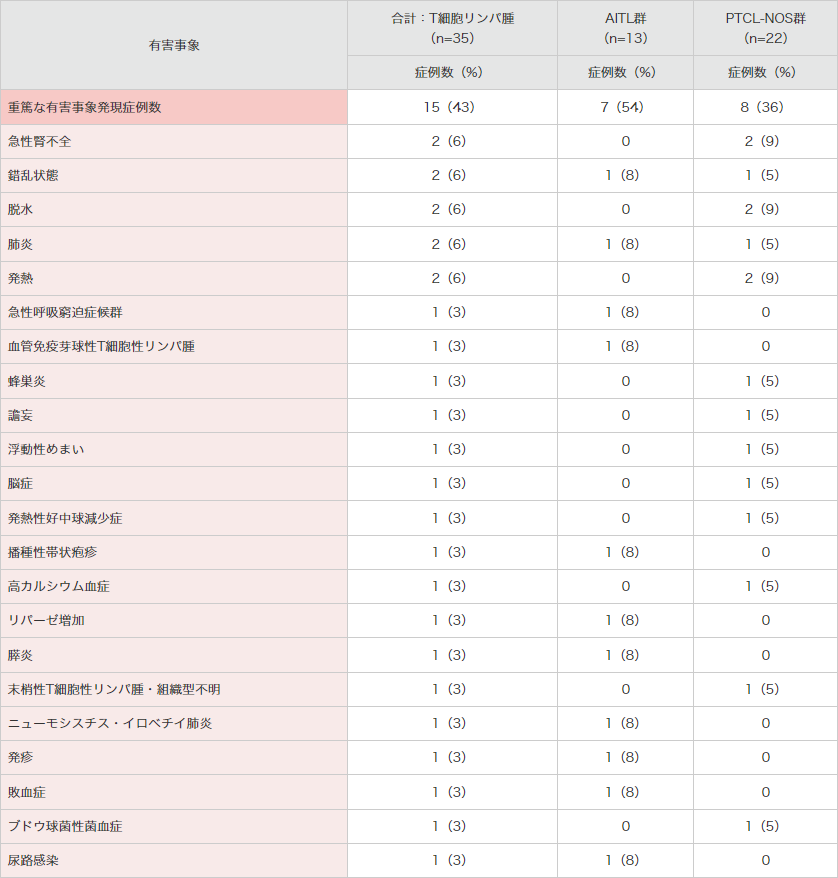
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計。SGN35-012試験。
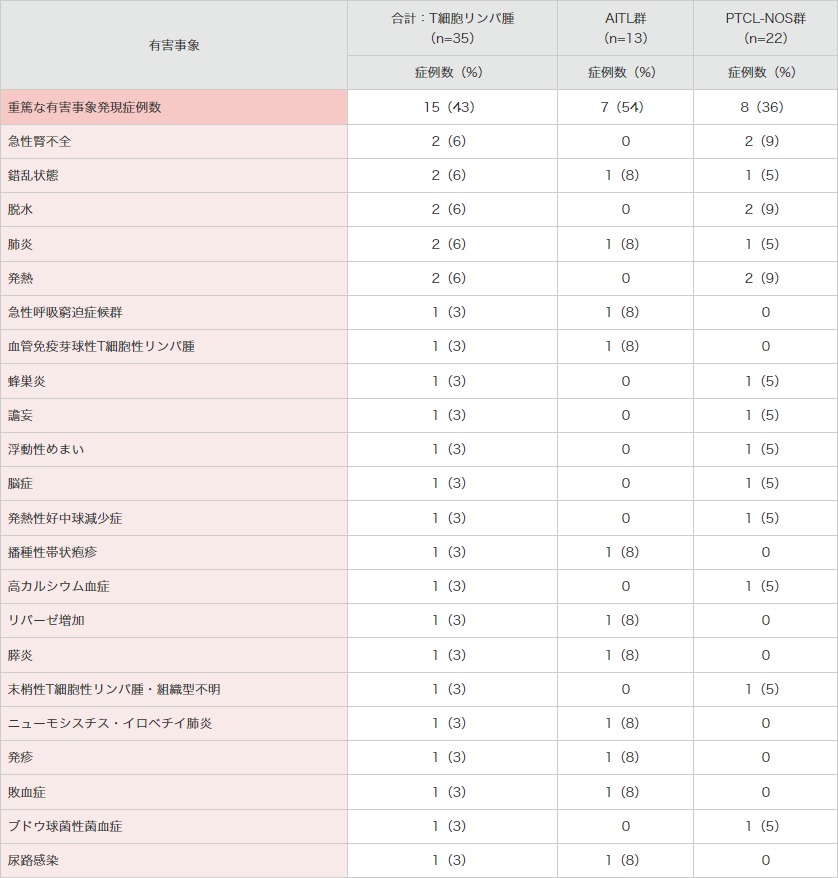
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計。SGN35-012試験。
注意すべき有害事象:末梢神経障害
■ 末梢神経障害の発現状況
再発又は難治性のCD30陽性の末梢性T細胞リンパ腫患者を対象とした海外第Ⅱ相試験(SGN35-012試験 パートA)では、末梢性ニューロパチー(SMQ)の発現頻度は35例中17例(49%)であり、そのうち4例(AITL群:3例、PTCL-NOS群:1例)ではGrade 3の事象が認められました。
2例以上の末梢神経障害は、末梢性感覚ニューロパチー、感覚鈍麻、末梢性運動ニューロパチーでした。
● 海外第Ⅱ相試験(SGN35-012試験)における末梢神経障害の発現状況(2例以上)4)
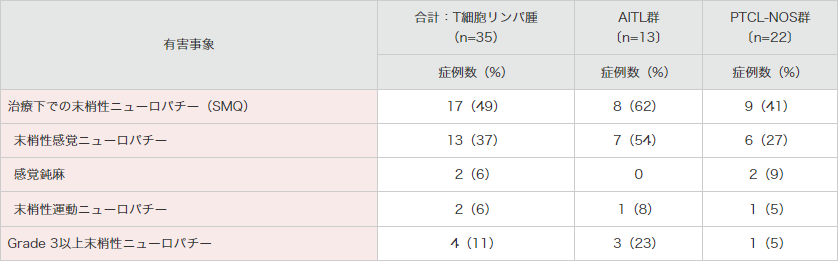
SMQ:MedDRA標準検索式。
末梢性ニューロパチーには、末梢性ニューロパチー(SMQ)のイベントが幅広く含まれる。
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計
海外第Ⅱ相試験(SGN35-012試験)
集計期間:2011年8月19日~2015年6月1日
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
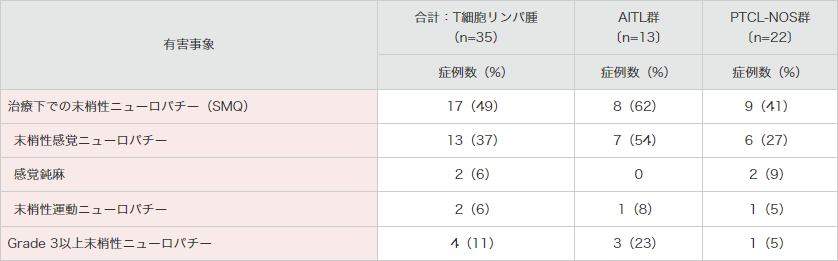
SMQ:MedDRA標準検索式。
末梢性ニューロパチーには、末梢性ニューロパチー(SMQ)のイベントが幅広く含まれる。
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計
海外第Ⅱ相試験(SGN35-012試験)
集計期間:2011年8月19日~2015年6月1日
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
末梢神経障害の発現時期
再発又は難治性のCD30陽性の末梢性T細胞リンパ腫患者を対象とした海外第Ⅱ相試験(SGN35-012試験 パートA)では、末梢性ニューロパチー関連事象が1件以上発現したT細胞リンパ腫被験者における初回発現までの期間(中央値)は、6.1週間(範囲:0.1~56.0週間)でした。
Grade 3以上の事象の発現までの期間(中央値)は、24.7週間(15.6~34.3週間)でした。
● 海外第Ⅱ相試験(SGN35-012試験)における末梢性ニューロパチー関連事象の初回発現までの期間4)
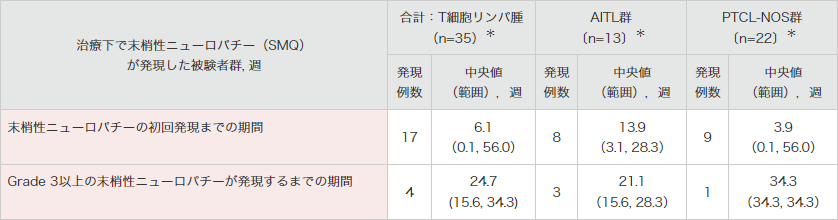
末梢性ニューロパチーには、末梢性ニューロパチー(SMQ)のイベントが幅広く含まれる。
*1つ以上の治験治療下発現末梢性ニューロパチー事象を発現した被験者
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計
海外第Ⅱ相試験(SGN35-012試験)
集計期間:2011年8月19日~2015年6月1日
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
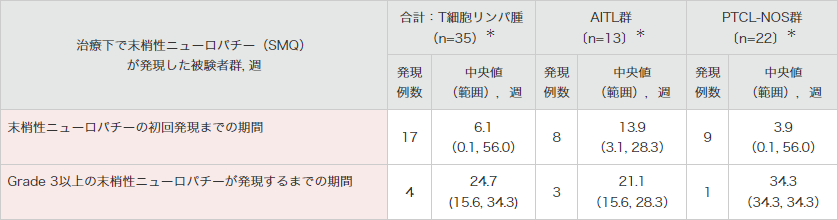
末梢性ニューロパチーには、末梢性ニューロパチー(SMQ)のイベントが幅広く含まれる。
*1つ以上の治験治療下発現末梢性ニューロパチー事象を発現した被験者
MedDRA Ver.18.0、NCI-CTCAE Ver.4.03により集計
海外第Ⅱ相試験(SGN35-012試験)
集計期間:2011年8月19日~2015年6月1日
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
末梢神経障害の消失又は改善
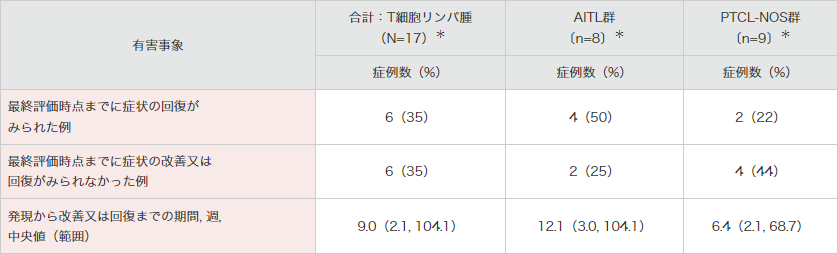
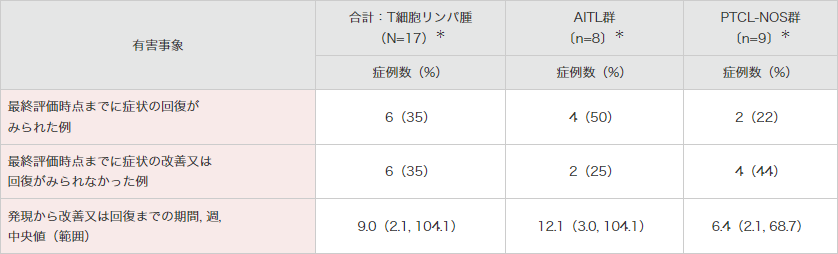
海外第Ⅱ相試験(SGN35-012試験:n=35)では、末梢性ニューロパチー関連事象が発現したT細胞リンパ腫被験者のうち、最終評価時点までにすべての事象が回復した被験者の割合は17例中6例(35%)でした。
また、最終評価時点で末梢性ニューロパチー関連事象の改善又は回復がみられなかった被験者は6例(35%)でした4)。
*1つ以上の治験治療下発現末梢性ニューロパチー事象を発現した被験者
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
*1つ以上の治験治療下発現末梢性ニューロパチー事象を発現した被験者
4)ブレンツキシマブ ベドチンの海外臨床試験成績③(2019年12⽉20⽇承認、CTD 2.7.6.3)(承認審査時評価資料)
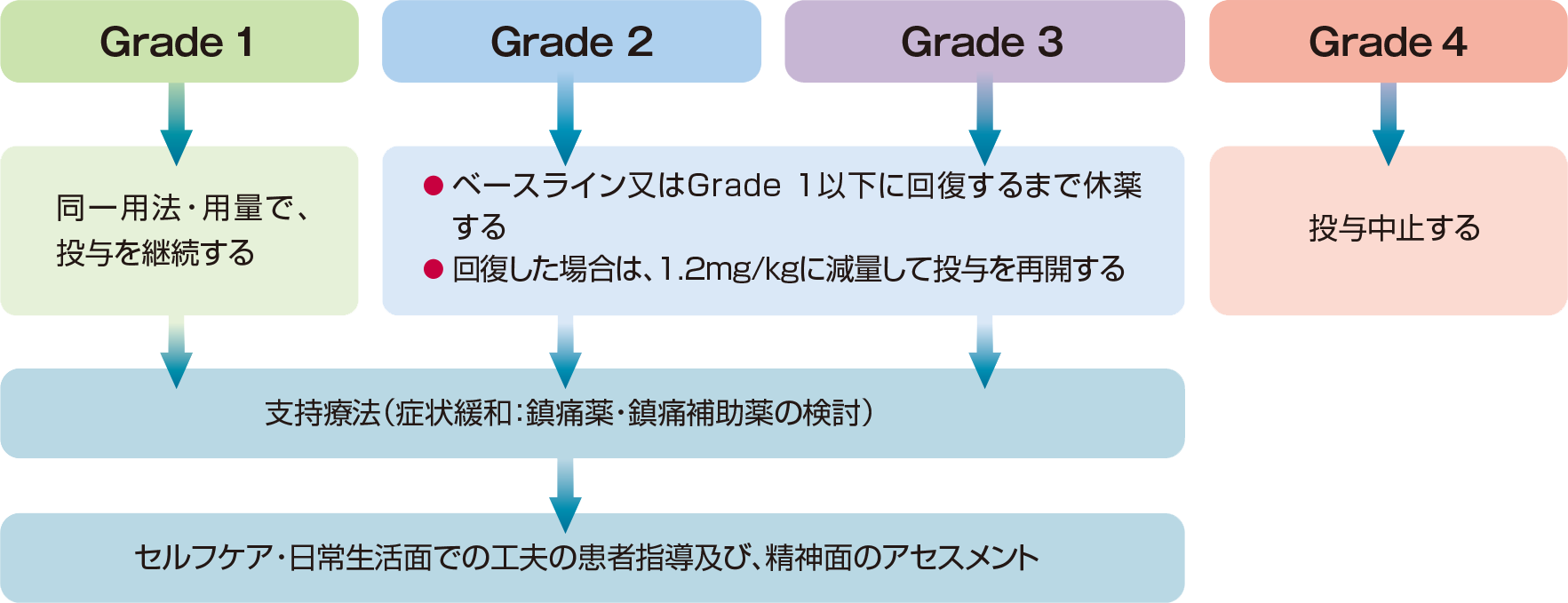
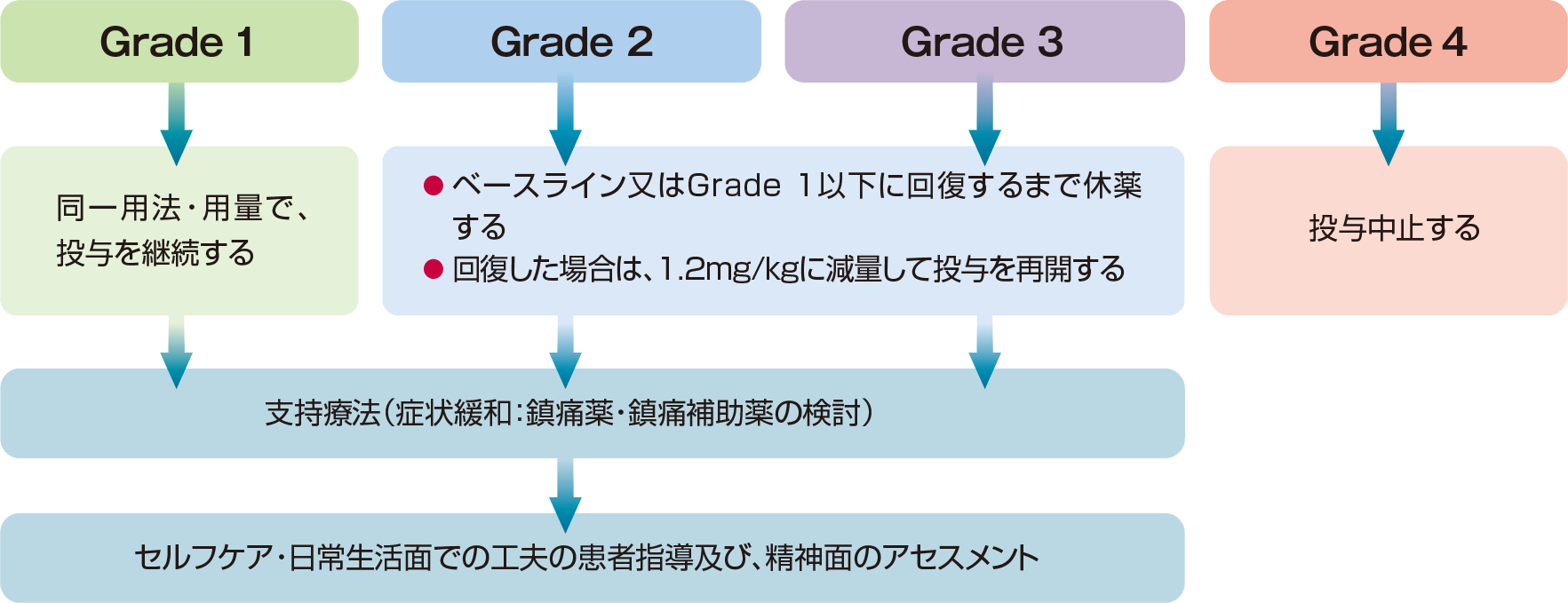
用法及び用量に関連する注意
ブレンツキシマブ ベドチンの投与により、Grade 2以上の末梢神経障害があらわれた場合には、以下の基準を参考に減量、休薬、中止などの適切な処置を行ってください。


● ブレンツキシマブ ベドチンによる、末梢神経障害の対処5)
5)ブレンツキシマブ ベドチン(遺伝⼦組換え)注 国内電⼦添⽂2023年7⽉改訂(第3版)より作図
5)ブレンツキシマブ ベドチン(遺伝⼦組換え)注 国内電⼦添⽂2023年7⽉改訂(第3版)より作図
● 末梢神経障害発現時の用量調節の目安5)
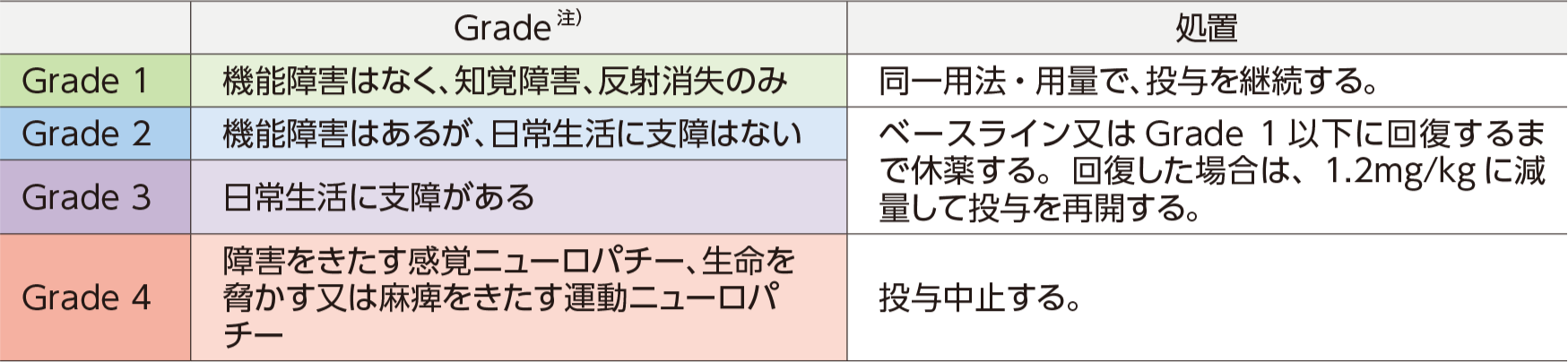
注)GradeはNCI-CTCAEに基づく。
参考:NCI-CTCAE Q.4参照
5)ブレンツキシマブ ベドチン(遺伝⼦組換え)注 国内電⼦添⽂2023年7⽉改訂(第3版)より作表
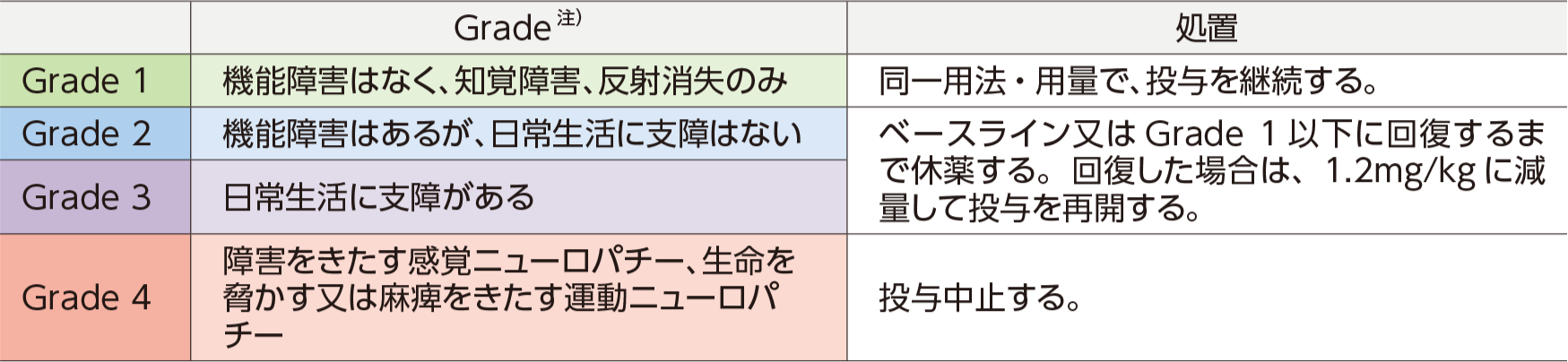
注)GradeはNCI-CTCAEに基づく。
参考:NCI-CTCAE Q.4参照
5)ブレンツキシマブ ベドチン(遺伝⼦組換え)注 国内電⼦添⽂2023年7⽉改訂(第3版)より作表