アドセトリス点滴静注用50mg 発売中
末梢性T細胞リンパ腫


臨床成績
「警告・禁忌を含む使⽤上の注意」につきましては、「電子添文」をご参照ください。
国際共同第Ⅲ相⼆重盲検試験:検証試験、SGN35-014試験(ECHELON-2試験)
ブレンツキシマブ ベドチンの国際共同第Ⅲ相試験成績②(2019年12⽉20⽇承認、CTD 2.7.6.1、2.7.3.3、2.7.4.2)(承認審査時評価資料)
Horwitz S, et al.: Lancet. 2019; 393: 229-240.
本試験は、Seattle Genetics社(現・Seagen社)とMillennium Pharmaceuticals社(現・武⽥薬品⼯業株式会社)の資⾦提供により実施された。
本論⽂の著者のうちそれぞれ4名、2名は同社の社員で、試験計画、解析、執筆等の⽀援を受けている。著者に同社より研究⽀援、謝礼⾦等を受領している者が含まれる。
Horwitz S, et al.: Lancet. 2019; 393: 229-240, supplementary appendix.
試験概要を確認する
試験概要
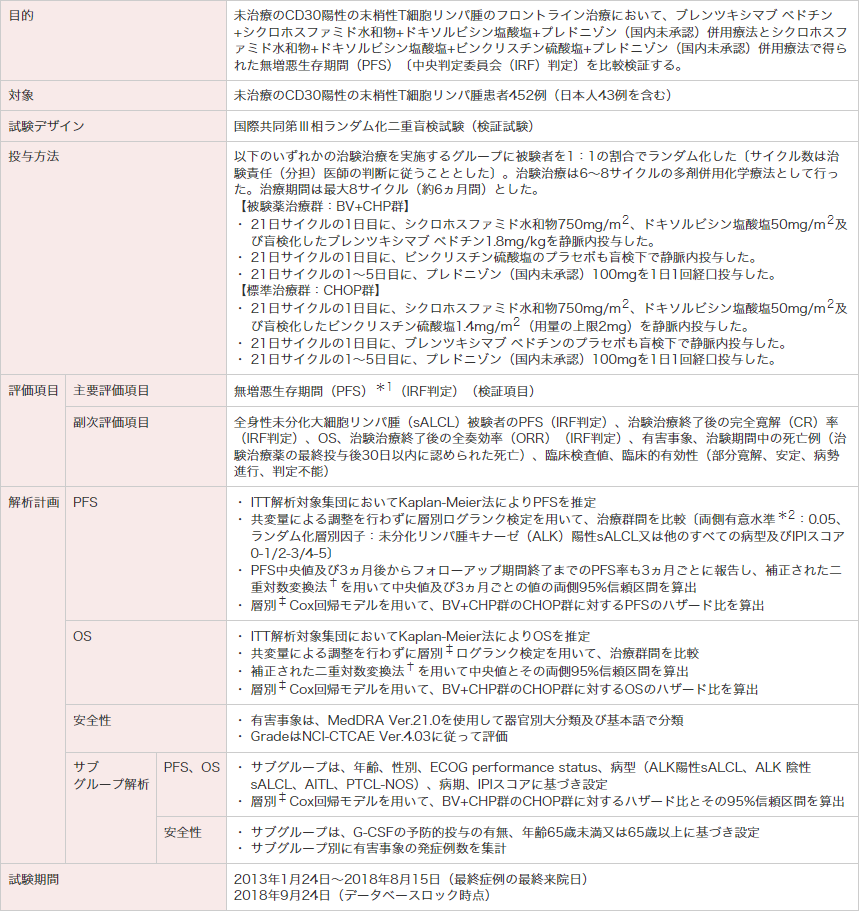
ECOG:米国東海岸がん臨床試験グループ。ITT:intent-to-treat。ALCL:未分化大細胞リンパ腫。IPI:国際予後指標。OS:全生存期間。
*1 PFSは、ランダム化日から次のいずれかの事象が最初に発現した日までの期間と定義した。
1. 最初に病勢進行(PD)と判定された日。2. 死亡日(死因は問わない)。3. 残存腫瘍又はPDにより次の抗がん化学療法を実施した日(地固め治療としての自家移植、放射線治療は除く)。
*2 統計解析計画書では片側検定を計画していたが、治験総括報告書では両側検定でp値を算出し、p<0.05の場合に、片側有意水準0.025と同等の有意差があるとした。
† Collett D. Modelling survival data in medical research. London, Chapman & Hall. 1994; 237-251.
‡ ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
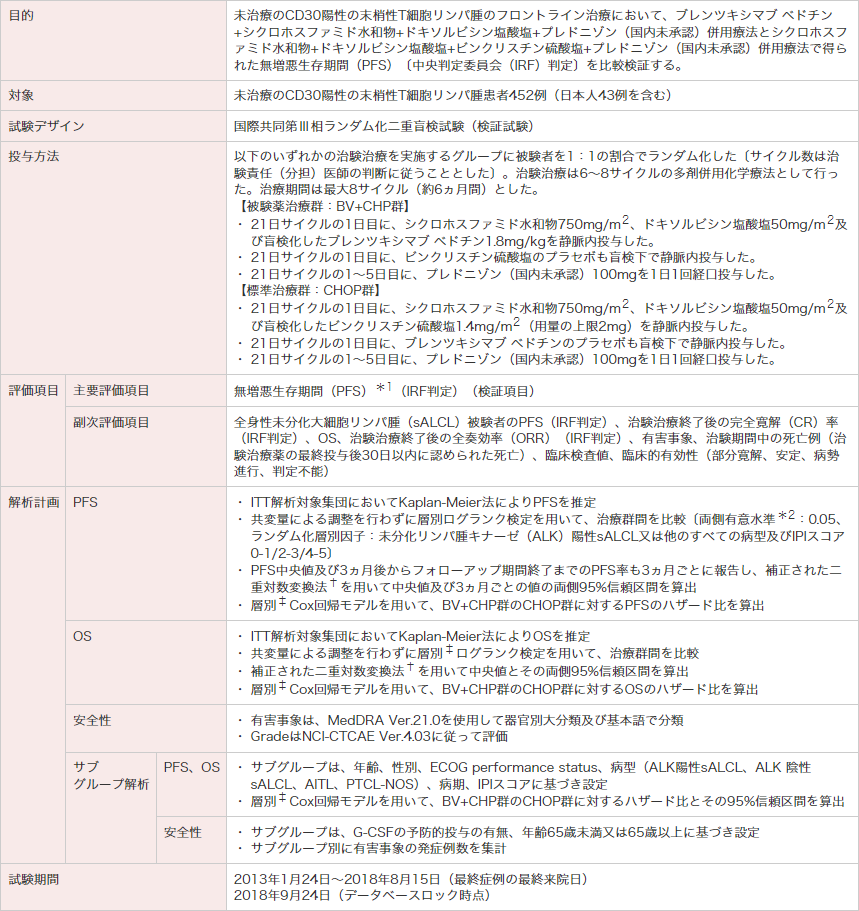
ECOG:米国東海岸がん臨床試験グループ。ITT:intent-to-treat。ALCL:未分化大細胞リンパ腫。IPI:国際予後指標。OS:全生存期間。
*1 PFSは、ランダム化日から次のいずれかの事象が最初に発現した日までの期間と定義した。
1. 最初に病勢進行(PD)と判定された日。2. 死亡日(死因は問わない)。3. 残存腫瘍又はPDにより次の抗がん化学療法を実施した日(地固め治療としての自家移植、放射線治療は除く)。
*2 統計解析計画書では片側検定を計画していたが、治験総括報告書では両側検定でp値を算出し、p<0.05の場合に、片側有意水準0.025と同等の有意差があるとした。
† Collett D. Modelling survival data in medical research. London, Chapman & Hall. 1994; 237-251.
‡ ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
試験デザイン
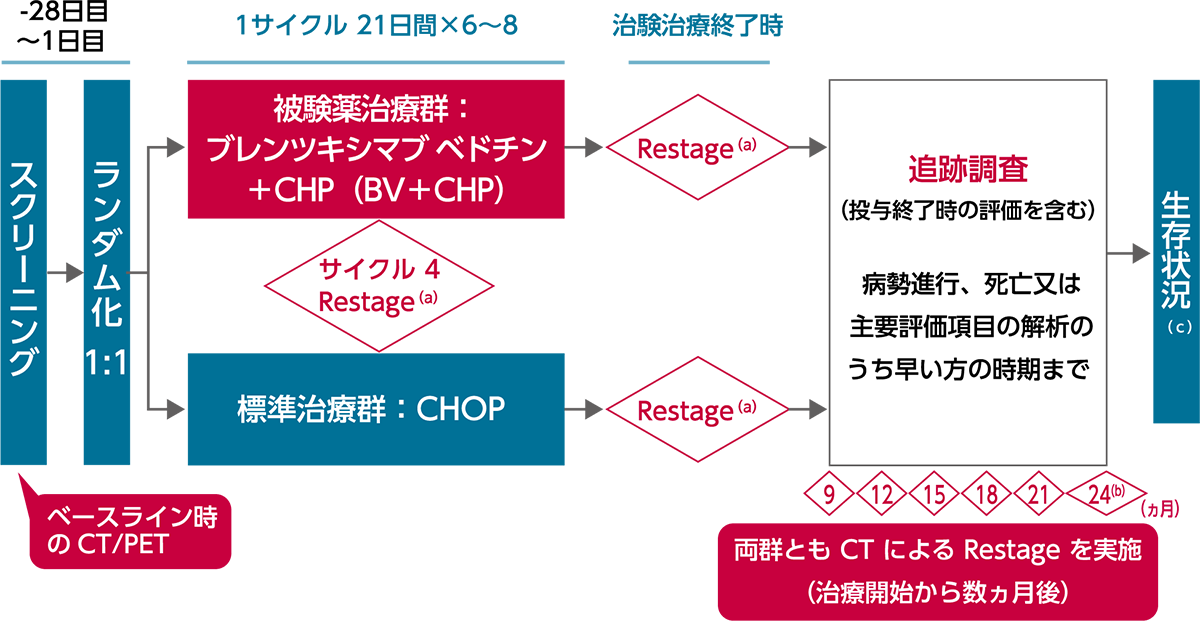
(a)コンピューター断層撮影法(CT)及びポジトロン断層撮影(PET)を施工。
(b)24ヵ月以後、治験責任(分担)医師の判定によるPD、死亡、又は主要評価項目の解析のいずれか早い時期まで6ヵ月ごとにCTを施工する。
(c)PDが確認された被験者については、死亡又は治験終了のいずれか早い時期まで6ヵ月ごとに生存期間の追跡調査を継続する。
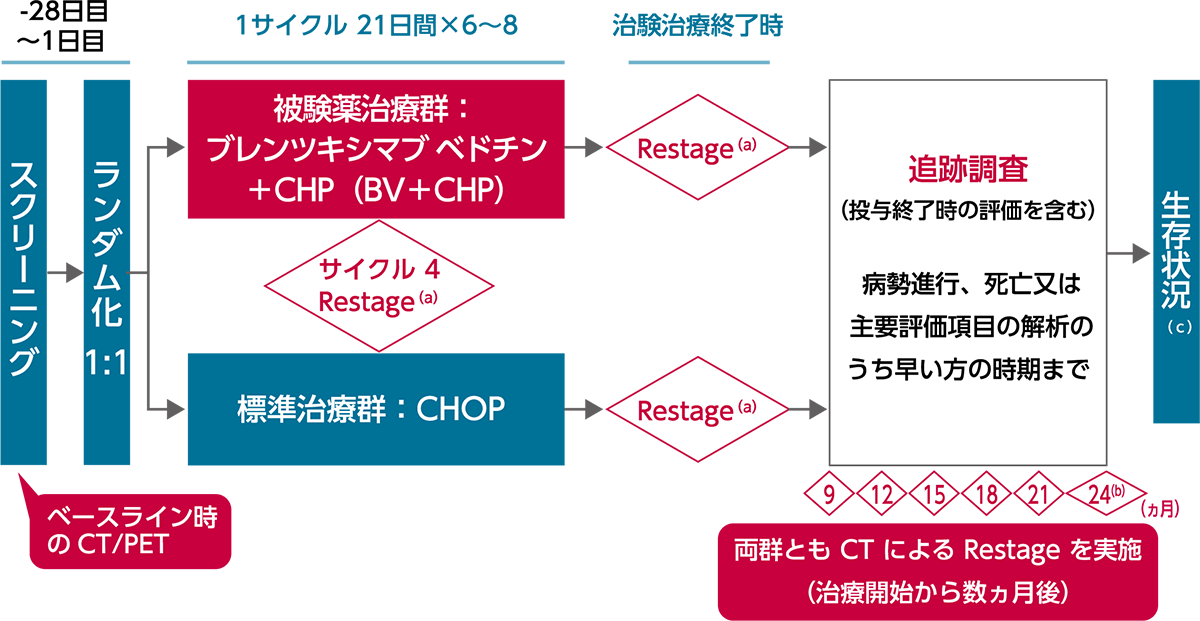
(a)コンピューター断層撮影法(CT)及びポジトロン断層撮影(PET)を施工。
(b)24ヵ月以後、治験責任(分担)医師の判定によるPD、死亡、又は主要評価項目の解析のいずれか早い時期まで6ヵ月ごとにCTを施工する。
(c)PDが確認された被験者については、死亡又は治験終了のいずれか早い時期まで6ヵ月ごとに生存期間の追跡調査を継続する。
試験結果を確認する
PFS[主要評価項⽬](検証項⽬)
ブレンツキシマブ ベドチン(BV)の初発PTCL患者さんに対するBV+CHP療法とCHOP療法を比較した国際共同第Ⅲ相ランダム化二重盲検試験(ECHELON-2試験)の結果が2019年に報告されました1)。
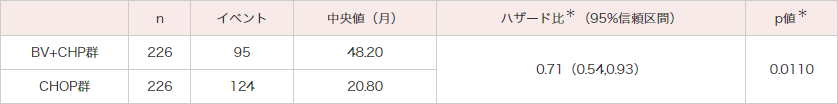
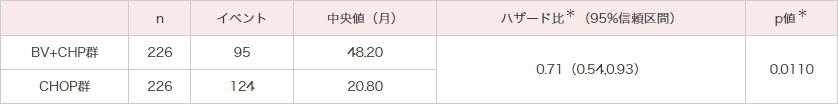
ECHELON-2試験では、18歳以上のCD30陽性率10%以上、未治療のPTCL452例を対象にBV+CHP群226例とCHOP群226例にランダム化されました。主要評価項目であるPFSの中央値はBV+CHP群で48.2ヵ月、CHOP群で20.8ヵ月であり、統計学的に有意なPFSの延長が認められました(ハザード比:0.71;95%信頼区間:0.54〜0.93[層別*Cox回帰モデル]、p=0.0110[層別*ログランク検定])(図1)。その結果、BV+CHP群のCHOP群に対する優越性が検証されました。
1)Horwitz S, et al.: Lancet. 2019; 393(10168): 229-240.
図1|PFSのKaplan-Meier曲線(ITT解析対象集団)(IRF判定)[主要評価項⽬]
(データカットオフ⽇2018年8⽉15⽇)
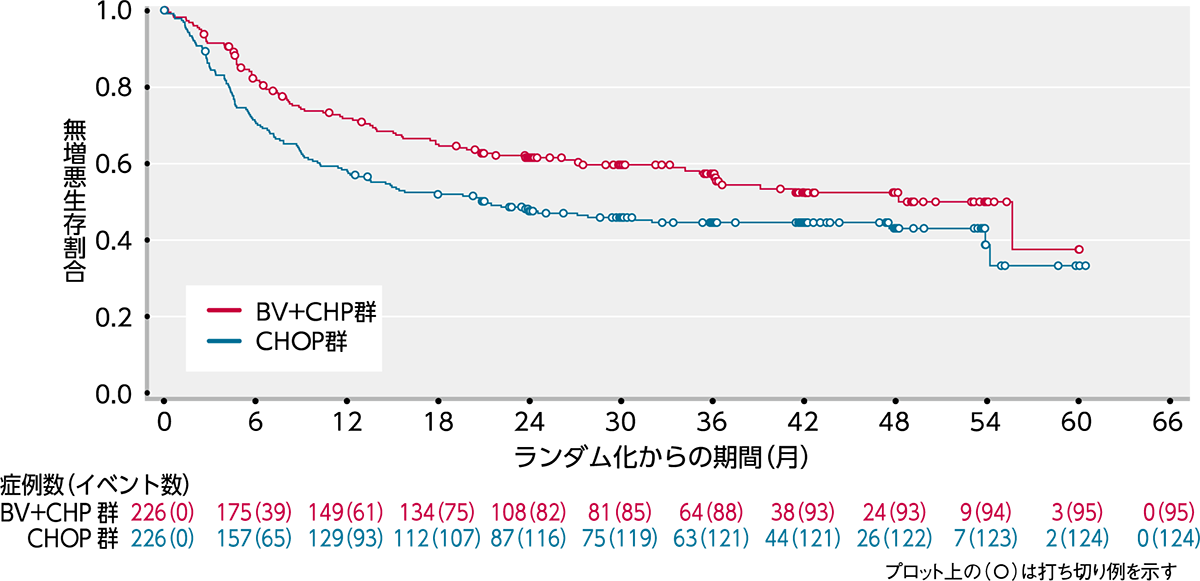
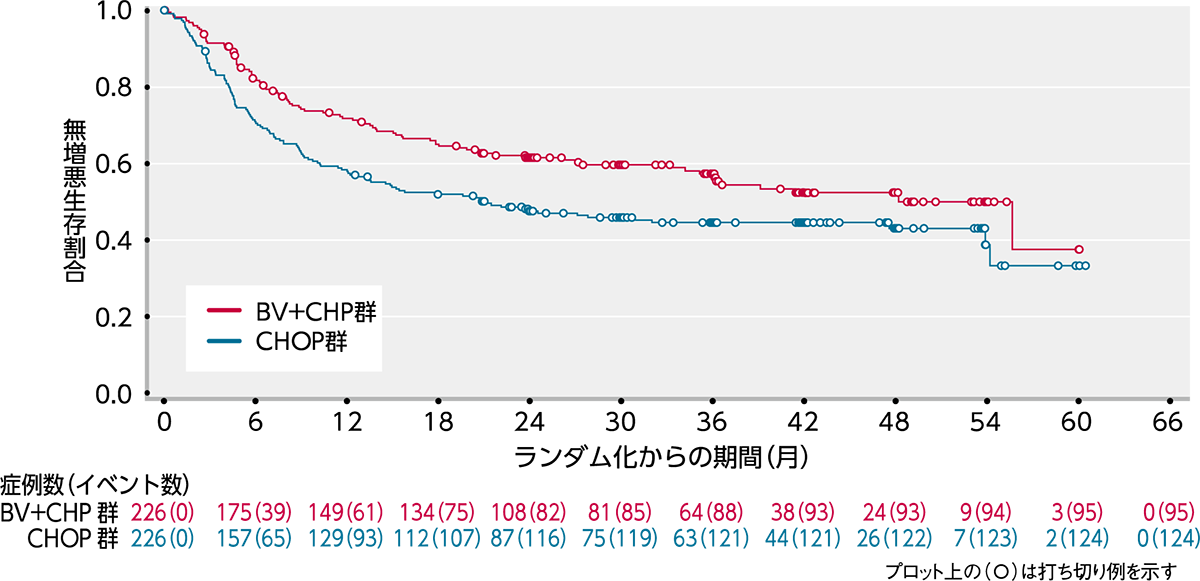
* P値は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別ログランク検定により算出した。また、ハザード比は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別Cox回帰モデルにより算出した。
* P値は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別ログランク検定により算出した。また、ハザード比は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別Cox回帰モデルにより算出した。
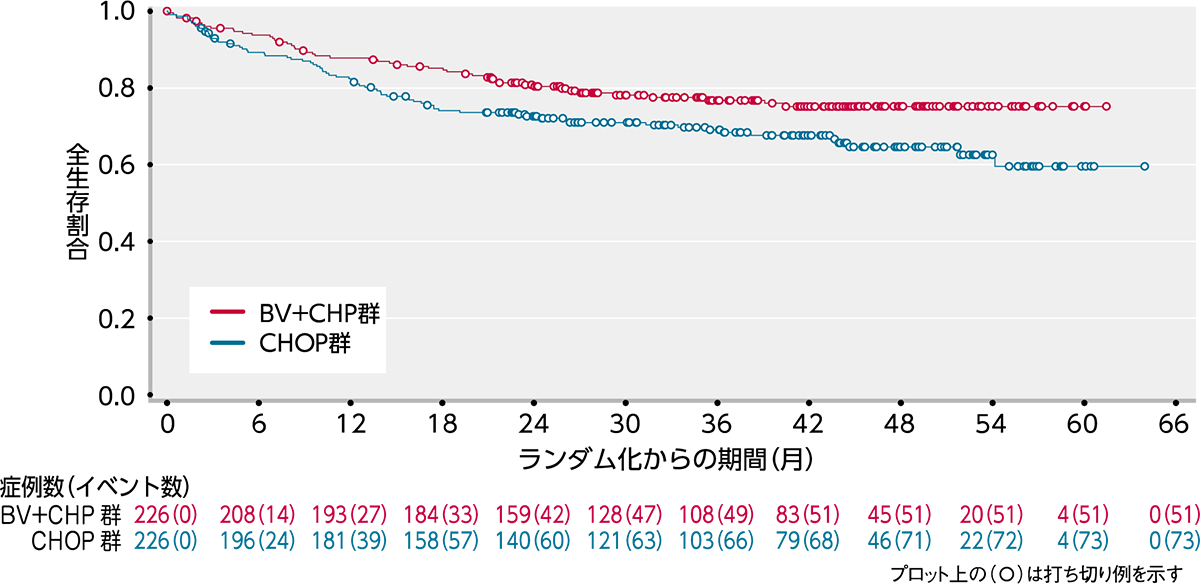
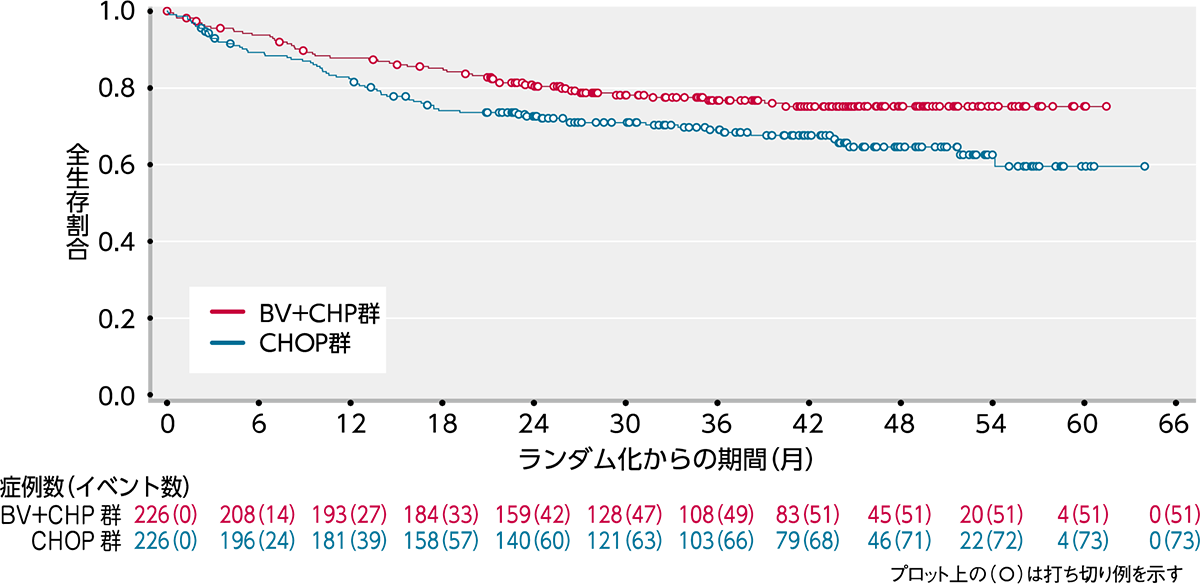
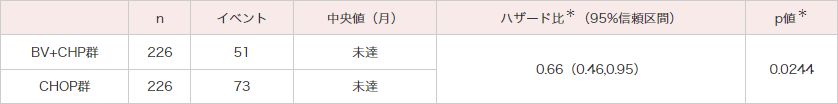
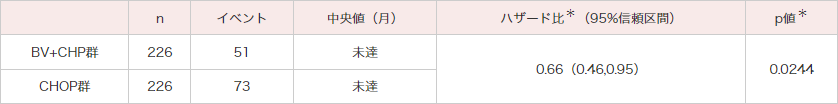
OS[副次評価項⽬]
OSにおいてもBV+CHP群ではCHOP群と比較して統計的に有意なOSの延長が認められました(ハザード比:0.66;95%信頼区間:0.46〜0.95[層別*Cox回帰モデル]、p=0.0244[層別*ログランク検定])(図2)。
図2|OSのKaplan-Meier曲線(ITT解析対象集団)[副次評価項⽬]
(データカットオフ⽇2018年8⽉15⽇)
* P値は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別ログランク検定により算出した。また、ハザード比は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別Cox回帰モデルにより算出した。
* P値は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別ログランク検定により算出した。また、ハザード比は、ランダム化層別因子(ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5)を用いた層別Cox回帰モデルにより算出した。
PFS[主要評価項⽬][サブグループ解析]
サブグループ解析における病型ごとのPFSに対するBV+CHP群のハザード比の点推定値は、ALK陽性sALCL:0.29(95%信頼区間:0.11~0.79)、ALK陰性sALCL:0.65(95%信頼区間:0.44~ 0.95)、AITL:1.40(95%信頼区間:0.64~3.07)、PTCL-NOS:0.75(95%信頼区間:0.41~1.37)でした(図3)。
図3|ベースライン特性、予後因⼦及び病型別のPFSのフォレストプロット(ITT解析対象集団)(IRF判定)
[主要評価項⽬][サブグループ解析]
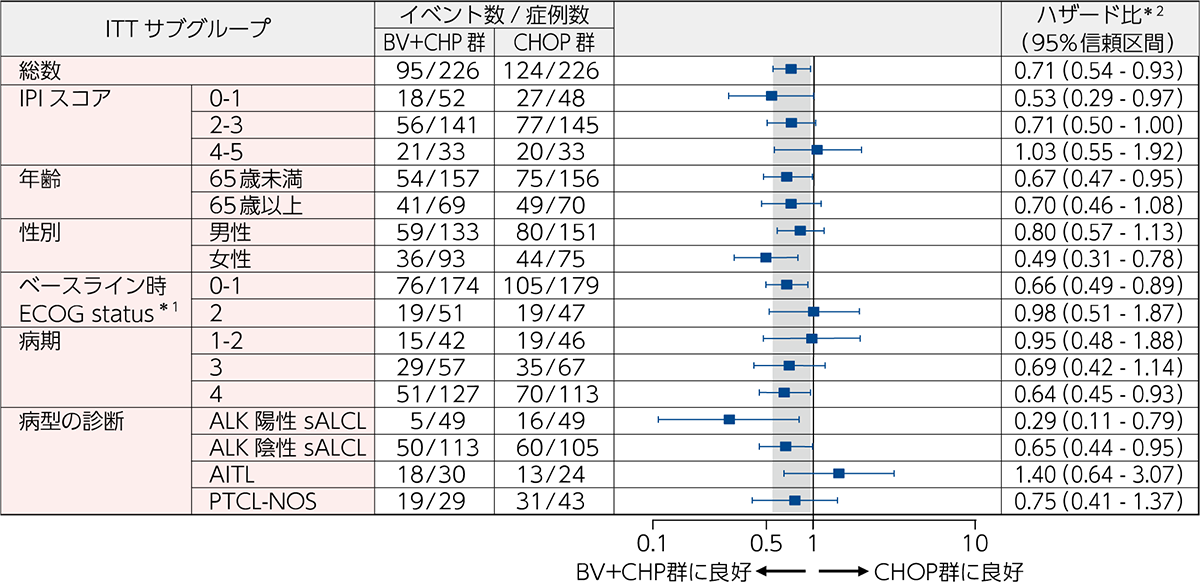
BV+CHP群とCHOP群を比較するためのハザード比、及び95%信頼区間は、無作為化時の層別因子*2を考慮したCox回帰モデルにより算出した。IPIサブグループは、BV+CHP群の1例(0–1から2–3へ)及びCHOP群の1例(4–5から2–3へ)で無作為化後に変更となった。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり; 0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
*2 ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
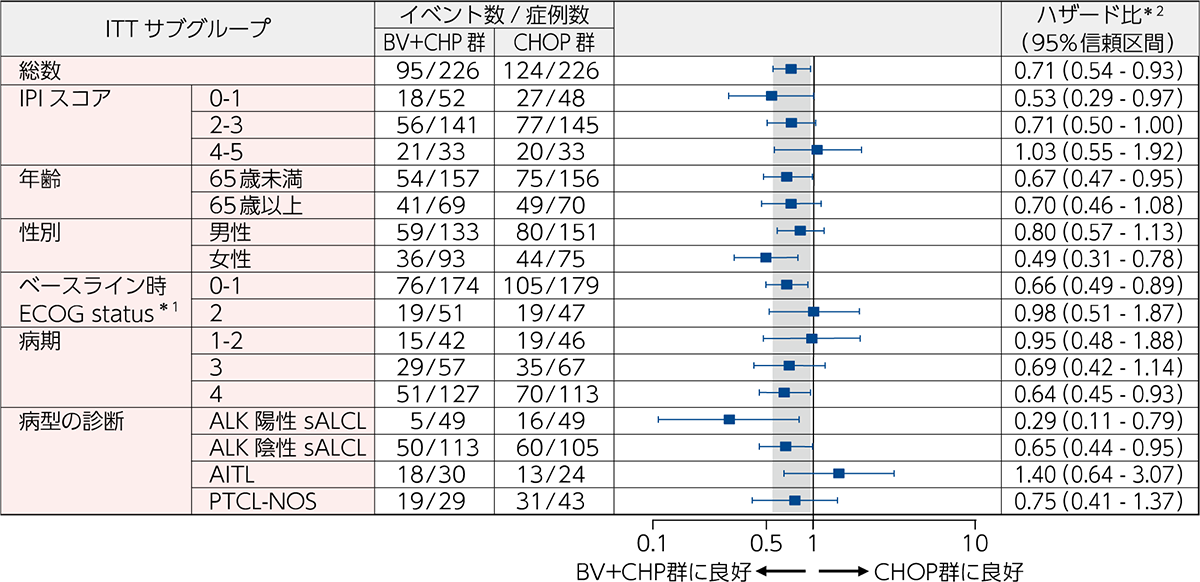
BV+CHP群とCHOP群を比較するためのハザード比、及び95%信頼区間は、無作為化時の層別因子*2を考慮したCox回帰モデルにより算出した。IPIサブグループは、BV+CHP群の1例(0–1から2–3へ)及びCHOP群の1例(4–5から2–3へ)で無作為化後に変更となった。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり; 0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
*2 ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
OS[副次評価項⽬][サブグループ解析]
ECHELON-2試験のOS(サブグループ解析)は、ALK陽性及びALK陰性のsALCL、AITL、PTCL-NOSにおいてBV+CHP群のハザード比の点推定値(95%信頼区間)はそれぞれ、0.38(0.12-1.22)、0.58(0.35-0.98)、0.87(0.29-2.58)、0.83(0.38-1.80)でした(図4)。
図4|ベースライン特性、予後因⼦及び病型別のOSのフォレストプロット(ITT解析対象集団)
[副次評価項⽬][サブグループ解析]
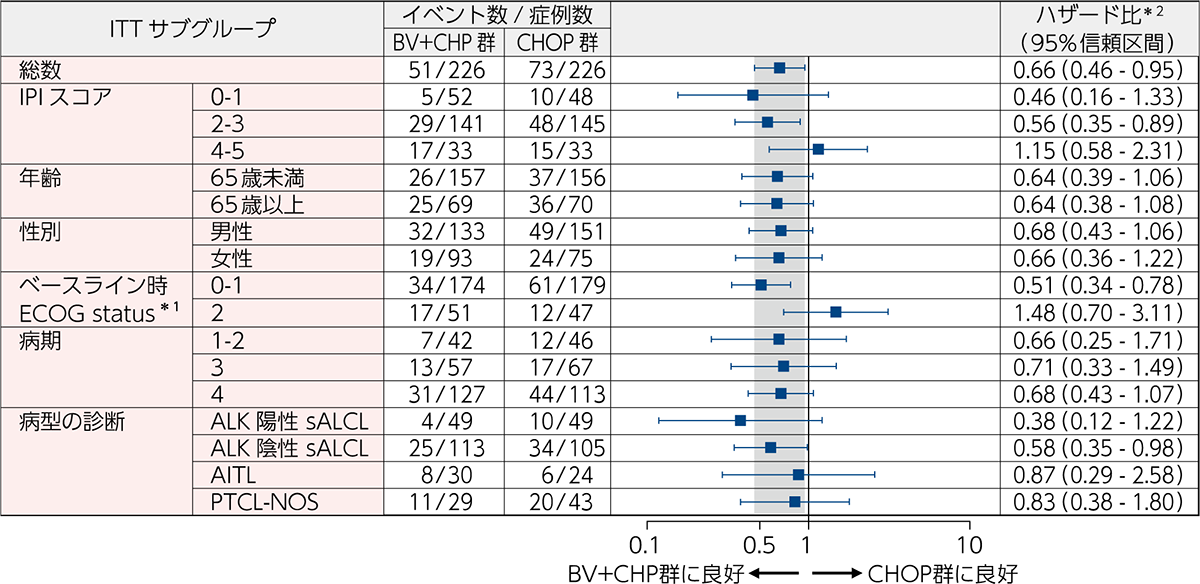
BV+CHP群とCHOP群を比較するためのハザード比、及び95%信頼区間は、無作為化時の層別因子*2を考慮したCox回帰モデルにより算出した。IPIサブグループは、BV+CHP群の1例(0–1から2–3へ)及びCHOP群の1例(4–5から2–3へ)で無作為化後に変更となった。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり; 0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
*2 ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
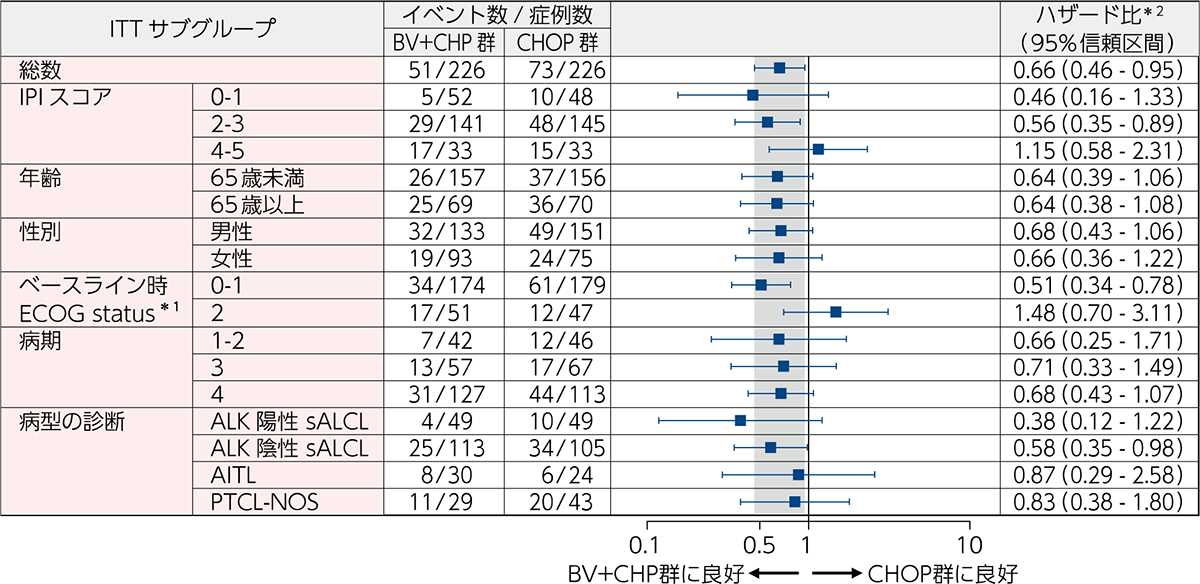
BV+CHP群とCHOP群を比較するためのハザード比、及び95%信頼区間は、無作為化時の層別因子*2を考慮したCox回帰モデルにより算出した。IPIサブグループは、BV+CHP群の1例(0–1から2–3へ)及びCHOP群の1例(4–5から2–3へ)で無作為化後に変更となった。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次のとおり; 0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。2:歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす(http://www.jcog.jpより引用)。
*2 ランダム化層別因子:ALK陽性sALCL又は他のすべての病型及びIPIスコア0-1/2-3/4-5。
安全性[副次評価項⽬]
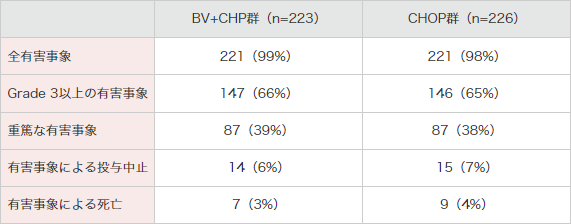
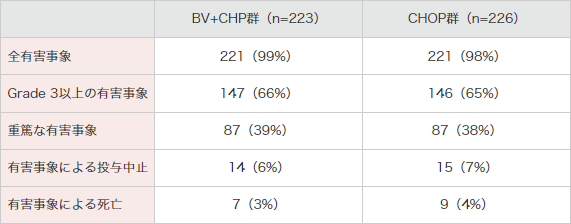
有害事象発現頻度は、BV+CHP群で223例(日本人20例含む)中221例(99%)及びCHOP群で226例(日本人23例含む)中221例(98%)でした(表1,表2)。
重篤な有害事象はBV+CHP群で87例(39%)及びCHOP群で87例(38%)に認められ、表3のとおりでした。
投与中止に至った有害事象はBV+CHP群で14例(6%)及びCHOP群で15例(7%)でした。有害事象の内訳は、BV+CHP群では、末梢性感覚ニューロパチー2例、心停止、成長障害、腸管穿孔、末梢性T細胞性リンパ腫・組織型不明、肺炎、誤嚥性肺炎、肺臓炎、肺空洞形成、発疹、呼吸不全、敗血症、心室細動〔以上、各1例〕でした。
CHOP群では、末梢性感覚ニューロパチー、敗血症、未分化大細胞型リンパ腫・T細胞およびヌル細胞型〔以上、各2例〕、心停止、肺炎、呼吸不全、不整脈、水疱、発熱性好中球減少症、水頭症、多臓器機能不全症候群、敗血症性ショック〔以上、各1例〕でした。
治験期間中の死亡例(治験治療薬の最終投与後30日以内に認められた死亡)はBV+CHP群で8例(4%)及びCHOP群で13例(6%)でした。治験期間中の死因の内訳は、BV+CHP群では、急性腎障害、心停止、末梢性T細胞性リンパ腫・組織型不明、肺炎、誤嚥性肺炎、肺空洞形成、敗血症、心室細動〔以上、各1例〕でした。CHOP群では、未分化大細胞型リンパ腫・T細胞およびヌル細胞型8例、敗血症、多臓器機能不全症候群〔以上、各2例〕及び心停止、不整脈、死亡、発熱性好中球減少症、水頭症、敗血症性ショック〔以上、各1例〕でした。
表1|国際共同第Ⅲ相試験(SGN35-014試験)における有害事象*の概要<併⽤投与時>
(安全性解析対象集団)[副次評価項⽬]
*:有害事象は新規に発現したもの(ベースライン時には症状がなかった)または最初の投与後に悪化したものとした。
*:有害事象は新規に発現したもの(ベースライン時には症状がなかった)または最初の投与後に悪化したものとした。
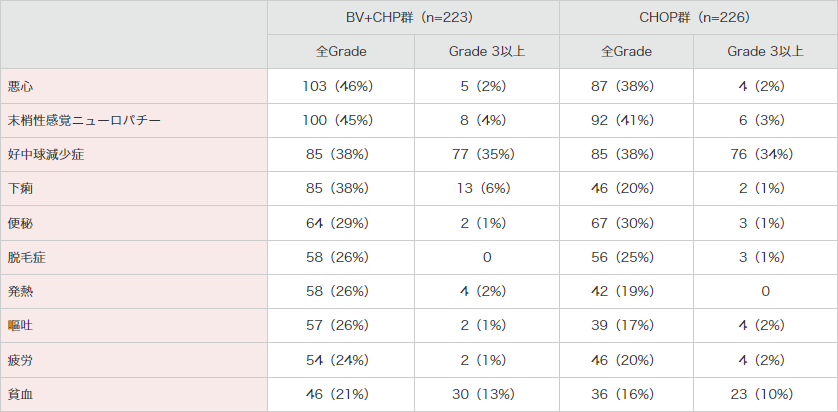
表2|国際共同第Ⅲ相試験(SGN35-014試験)における主な有害事象*
(いずれかの群で20%以上に発現した事象)<併⽤投与時>(安全性解析対象集団)[副次評価項⽬]
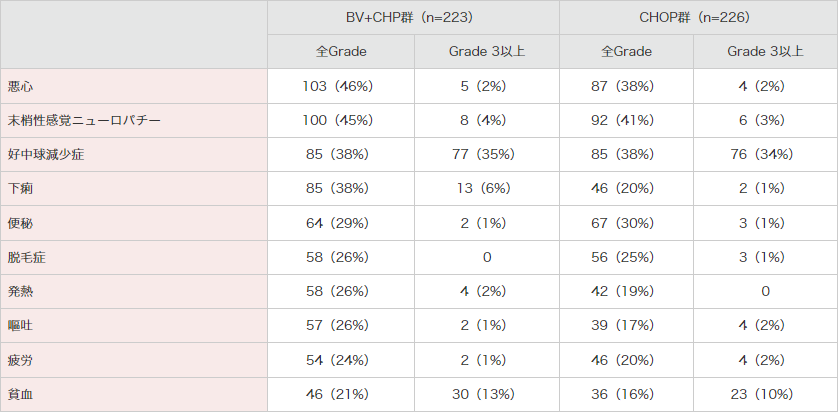
MedDRA Ver.21.0、NCI-CTCAE Ver.4.03により集計。
*:有害事象は新規に発現したもの(ベースライン時には症状がなかった)または最初の投与後に悪化したものとした。
MedDRA Ver.21.0、NCI-CTCAE Ver.4.03により集計。
*:有害事象は新規に発現したもの(ベースライン時には症状がなかった)または最初の投与後に悪化したものとした。
表3|国際共同第Ⅲ相試験(SGN35-014試験)における重篤な有害事象*
(本剤群で1例以上)<併⽤投与時>(安全性解析対象集団)[副次評価項⽬]
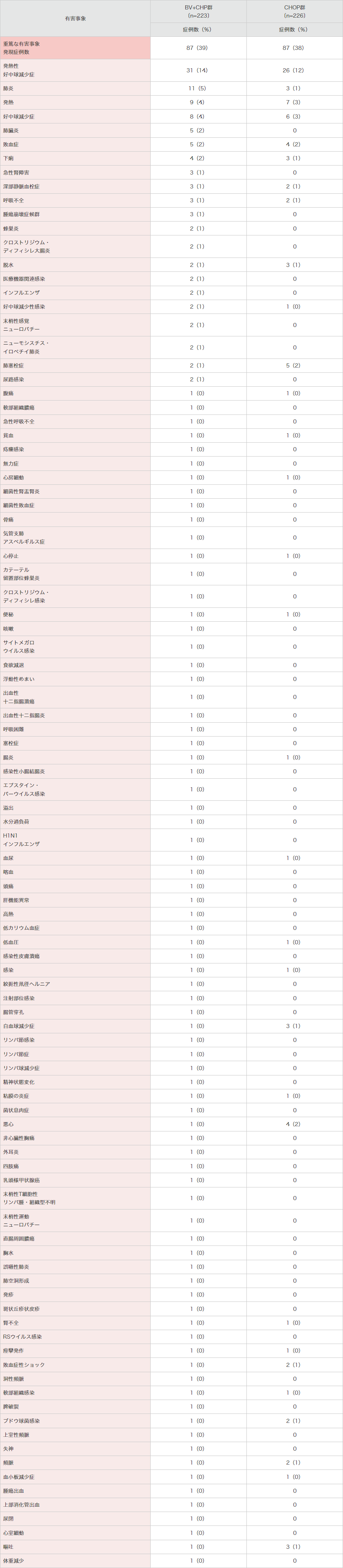
MedDRA Ver.21.0、NCI-CTCAE Ver.4.03により集計。
国際共同第Ⅲ相試験(SNG35-014試験)。
*本剤との関連が否定された事象を含む。
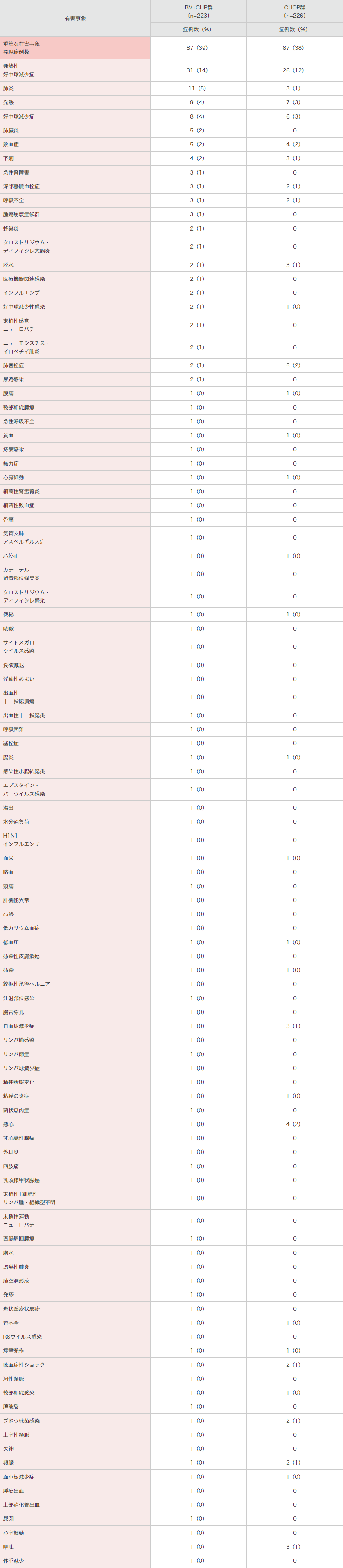
MedDRA Ver.21.0、NCI-CTCAE Ver.4.03により集計。
国際共同第Ⅲ相試験(SNG35-014試験)。
*本剤との関連が否定された事象を含む。
注意すべき有害事象:好中球減少等、末梢神経障害
<好中球減少等の発現状況>[副次評価項目][サブグループ解析]
G-CSFの予防的投与を受けた被験者は、BV+CHP群で75例(34%)及びCHOP群で61例(27%)でした。
BV+CHP群で発熱性好中球減少症が認められた被験者は、G-CSFの予防的投与を受けた被験者で12例(16%)であったのに対し、受けなかった被験者で29例(20%)でした。このうち、サイクル1で発熱性好中球減少症が認められた被験者は、G-CSFの予防的投与を受けた被験者で9例(12%)、受けなかった被験者で17例(11%)でした(表4)。
一次予防としてのG-CSFの投与は、治療サイクル1の8日目までにその投与を行った場合と定義した。
重要な有害事象に関連するリスク因子(G-CSFの予防的投与の有無、年齢65歳以上)に関して、G-CSFの予防的投与の有無別の発熱性好中球減少症及び関連するその他の有害事象の発現頻度、65歳以上の患者における有害事象のサブグループ解析を事後解析として実施した。解析結果は、承認審査評価資料に記載し、評価された。
表4|G-CSFの予防的投与の有無別の発熱性好中球減少症及び
関連するその他の有害事象*の発現頻度(安全性解析対象集団)[サブグループ解析]
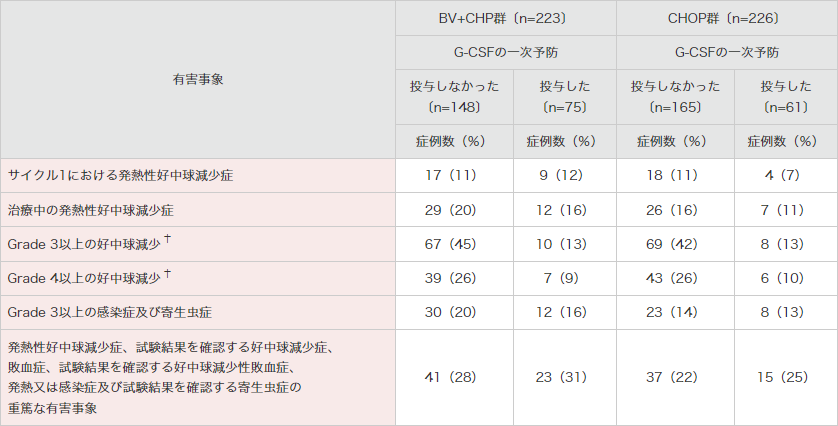
治療下で発現した有害事象は、ブレンツキシマブ ベドチン又は多剤化学療法を構成するいずれかの薬剤の初回投与後に新たに発現した(ベースライン時に発現していなかった)又は増悪した事象として定義し、示している。
G-CSF:顆粒球コロニー刺激因子。* 本剤との関連が否定された事象を含む。† 好中球減少症と好中球数減少の併合集計。MedDRA Ver.21.0、NCI-CTCAE ver.4.03により集計。
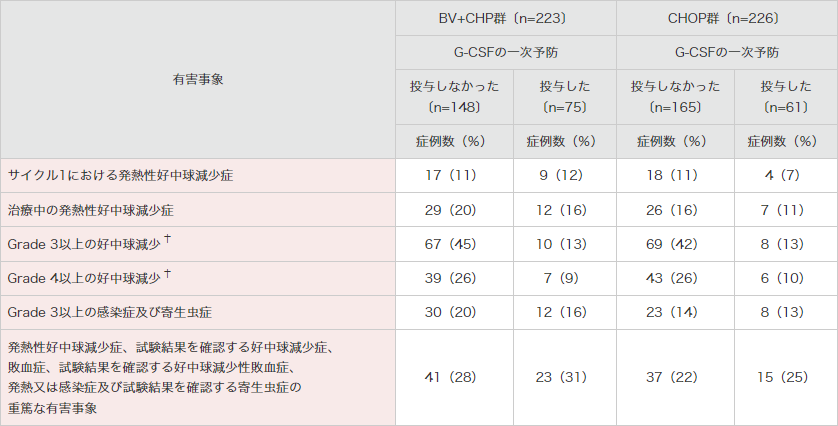
治療下で発現した有害事象は、ブレンツキシマブ ベドチン又は多剤化学療法を構成するいずれかの薬剤の初回投与後に新たに発現した(ベースライン時に発現していなかった)又は増悪した事象として定義し、示している。
G-CSF:顆粒球コロニー刺激因子。* 本剤との関連が否定された事象を含む。† 好中球減少症と好中球数減少の併合集計。MedDRA Ver.21.0、NCI-CTCAE ver.4.03により集計。
<末梢神経障害の発現状況>[副次評価項目]
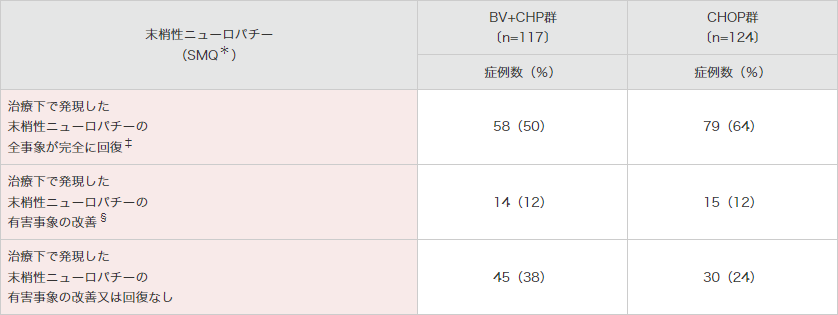
末梢性ニューロパチー(SMQ*)が、BV+CHP群で117例(52%)及びCHOP群で124例(55%)に認められました(表5)。末梢性ニューロパチーの全事象が完全回復した例は、BV+CHP群で58例(50%)で改善するまでの期間の中央値は17.0週、CHOP群では79例(64%)で改善するまでの期間の中央値は11.4週でした。
表5|末梢性ニューロパチーの概要(安全性解析対象集団)
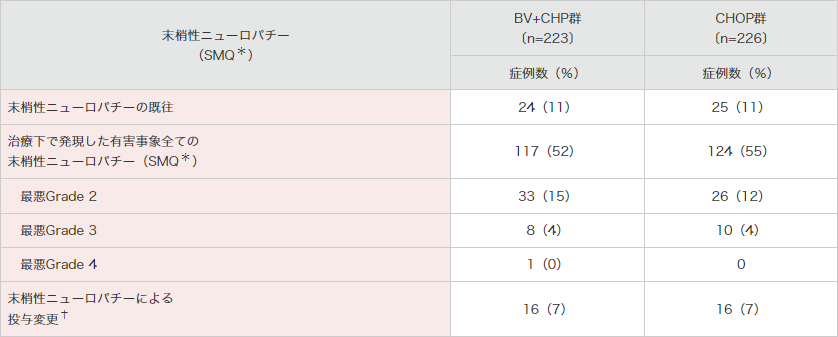
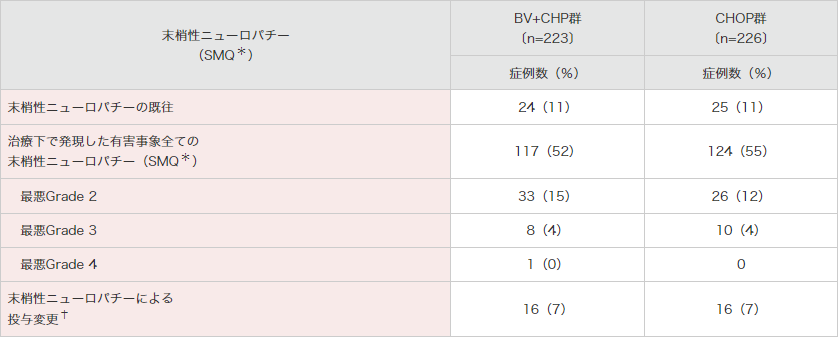
SMQ:Standardised MedDRA Queries(MedDRA標準検索式)。
*:SMQには基本語の末梢性感覚ニューロパチー、錯感覚、末梢性運動ニューロパチー、筋力低下、末梢性感覚運動ニューロパチー、感覚鈍麻、異常感覚、反射消失、灼熱感、腓骨神経麻痺、多発ニューロパチー、自律神経ニューロパチー、歩行障害、筋萎縮、神経痛が含まれる。
†:末梢性ニューロパチーの有害事象を理由とする用量減量又は投与延期。
‡:回復の定義は、事象の消失/回復である、又は後遺症を伴う消失/回復である、若しくは既存事象の最新の評価で重症度がベースライン時以下に戻っていることとされる。
§:消失は改善を含意する。更に、消失していない事象については、改善の定義はその後に最悪Gradeと同等のGradeに至らず最悪Gradeより1Grade以上重症度が低下することとされる。最終経過観察時に事象の改善を認める被験者とは、1つ以上の事象の改善があり、その改善日が最終経過観察日以前である被験者を指す。全事象が消失した被験者は除外する。
MedDRA Ver.21.0、NCI-CTCAE ver.4.03により集計。
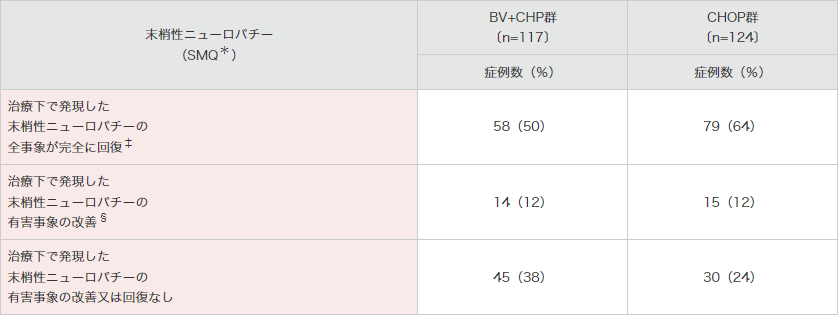
SMQ:Standardised MedDRA Queries(MedDRA標準検索式)。
*:SMQには基本語の末梢性感覚ニューロパチー、錯感覚、末梢性運動ニューロパチー、筋力低下、末梢性感覚運動ニューロパチー、感覚鈍麻、異常感覚、反射消失、灼熱感、腓骨神経麻痺、多発ニューロパチー、自律神経ニューロパチー、歩行障害、筋萎縮、神経痛が含まれる。
†:末梢性ニューロパチーの有害事象を理由とする用量減量又は投与延期。
‡:回復の定義は、事象の消失/回復である、又は後遺症を伴う消失/回復である、若しくは既存事象の最新の評価で重症度がベースライン時以下に戻っていることとされる。
§:消失は改善を含意する。更に、消失していない事象については、改善の定義はその後に最悪Gradeと同等のGradeに至らず最悪Gradeより1Grade以上重症度が低下することとされる。最終経過観察時に事象の改善を認める被験者とは、1つ以上の事象の改善があり、その改善日が最終経過観察日以前である被験者を指す。全事象が消失した被験者は除外する。
MedDRA Ver.21.0、NCI-CTCAE ver.4.03により集計。
長期成績を確認する
5年成績追跡調査結果(追跡調査期間中央値:66.8ヵ⽉)
Horwitz S, et al.:Ann Oncol. 2022; 33(3):288-298.
本試験はSeagen社とMillennium Pharmaceuticals社(現・武田薬品工業株式会社)の資金提供により実施された。
本論文の著者の2名はそれぞれの同社の社員で、試験計画、解析、執筆等の支援を受けている。
著者に同社より研究支援、謝礼金等を受領している者が含まれる。
治療下で報告された末梢性ニューロパチー関連事象は、BV+CHP群117例(52%)及びCHOP群124例(55%)でした(表6)。
5年目の追跡調査時では、BV+CHP群47例(21%)及びCHOP群42例(19%)で末梢性ニューロパチーの継続が認められており、BV+CHP群の最悪重症度では、Grade 1は47例中33例(70%)、Grade 2は13例(28%)及びGrade 3は1例(2%)でした。
CHOP群の最悪重症度では、Grade 1は42例中30例(64%)、Grade 2は11例(23%)及びGrade 3は1例(2%)でした。
末梢性ニューロパチーの改善又は回復は、BV+CHP群が117例中84例及びCHOP群が124例中97例でした。
二次発がんは14例に認められました。BV+CHP群で6例、CHOP群8例でした(表7)。
自家幹細胞移植を含むその後の抗癌療法は、二次性悪性腫瘍の患者のいずれについても報告されていません。
表6|末梢性ニューロパチー関連事象
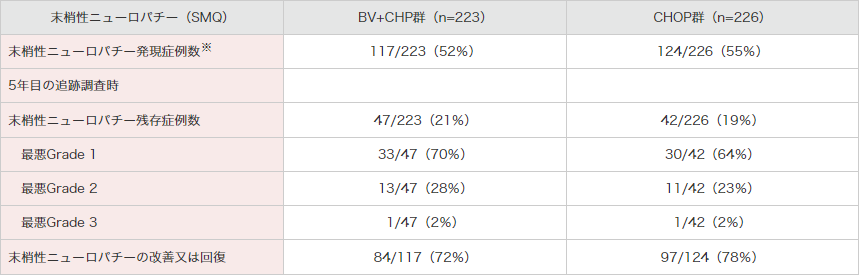
※:新規に発現したもの(ベースライン時には症状がなかった)又は最初の投与後に悪化したものとした。
追跡調査期間は中央値66.8カ月(範囲:0、90)
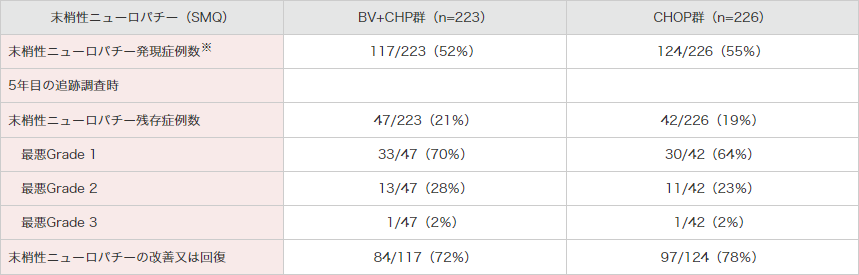
※:新規に発現したもの(ベースライン時には症状がなかった)又は最初の投与後に悪化したものとした。
追跡調査期間は中央値66.8カ月(範囲:0、90)
表7|二次発がん
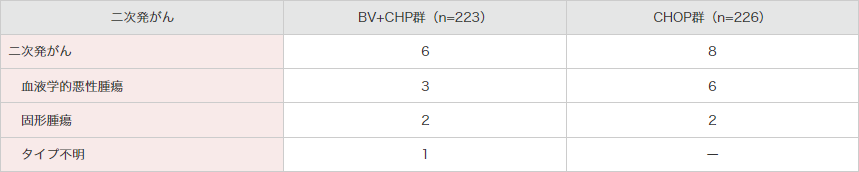
注)副次評価項目である有害事象に関して、ブレンツキシマブ ベドチンの医薬品リスク管理計画の【重要な特定されたリスク】の一つである末梢性ニューロパチー関連事象及び【重要な潜在的リスク】の一つである二次発がんを取り上げました。
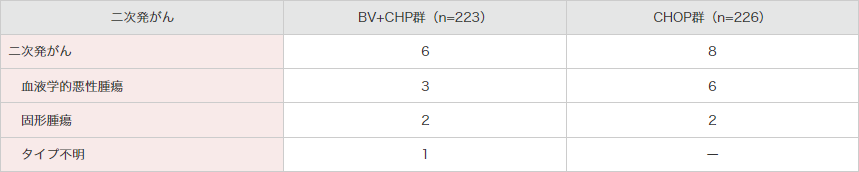
注)副次評価項目である有害事象に関して、ブレンツキシマブ ベドチンの医薬品リスク管理計画の【重要な特定されたリスク】の一つである末梢性ニューロパチー関連事象及び【重要な潜在的リスク】の一つである二次発がんを取り上げました。