アドセトリス点滴静注用50mg 発売中
進⾏期ホジキンリンパ腫


臨床成績
「警告・禁忌を含む使⽤上の注意」につきましては、「電子添文」をご参照ください。
再発⼜は難治性のCD30陽性のホジキンリンパ腫患者
(⾃家造⾎幹細胞移植施⾏後)を対象とした試験
(海外第Ⅱ相試験(⾮盲検試験):SG035-0003試験)
ブレンツキシマブ ベドチンの海外臨床試験成績①(2014 年1 ⽉17 ⽇承認, CTD 2.7.3.2、2.7.6.3)(承認審査時評価資料)
Younes A, et al. : J Clin Oncol. 2012; 30(18): 2183-2189.
本試験は、Seattle Genetics 社(現・Seagen 社)の資⾦提供により実施された。
本論⽂の著者のうち3名は同社の社員で、試験計画、解析、執筆等の⽀援を受けている。
著者にSeattle Genetics 社(現・Seagen社)、Millennium Pharmaceuticals社(現・武⽥薬品⼯業株式会社)より研究⽀援、謝礼⾦等を受領している者が含まれる。
試験概要を確認する
試験概要

PR:部分寛解。SD:安定。PD:病勢進⾏。NE:判定不能。
1)Cheson BD, et al.: J Clin Oncol. 2007; 25(5): 579-586.

PR:部分寛解。SD:安定。PD:病勢進⾏。NE:判定不能。
1)Cheson BD, et al.: J Clin Oncol. 2007; 25(5): 579-586.
試験結果を確認する
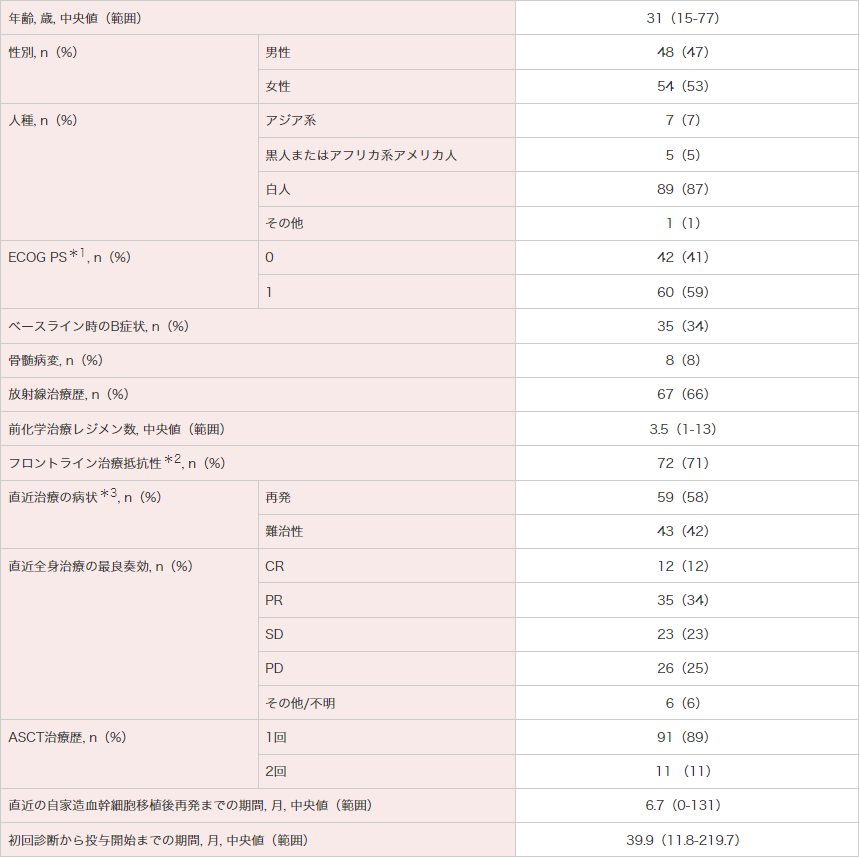
患者背景(ITT解析対象集団)

ECOG PS:米国東海岸がん臨床試験グループのパフォーマンスステータス。ASCT : 自家造血幹細胞移植。ITT:intent-to-treat。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次の通り;0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。
(http://www.jcog.jpより引用)
*2 フロントライン治療抵抗性はフロントライン治療で完全寛解を得られなかった、又はフロントライン治療後3ヵ月以内に再発した疾患と定義される。
*3 再発とは直近治療の最良奏効が完全寛解又は部分寛解を意味し、難治性とは直近治療の最良奏効がSD、PDを意味する。
ECOG PS:米国東海岸がん臨床試験グループのパフォーマンスステータス。ASCT : 自家造血幹細胞移植。ITT:intent-to-treat。
*1 ECOGによるPerformance Status(ECOG PS)の規準は次の通り;0:全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。1:肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。
(http://www.jcog.jpより引用)
*2 フロントライン治療抵抗性はフロントライン治療で完全寛解を得られなかった、又はフロントライン治療後3ヵ月以内に再発した疾患と定義される。
*3 再発とは直近治療の最良奏効が完全寛解又は部分寛解を意味し、難治性とは直近治療の最良奏効がSD、PDを意味する。
試験結果
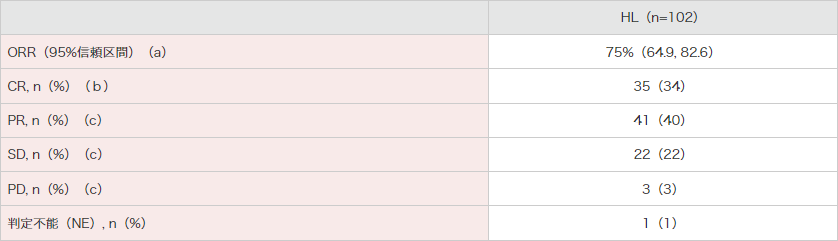
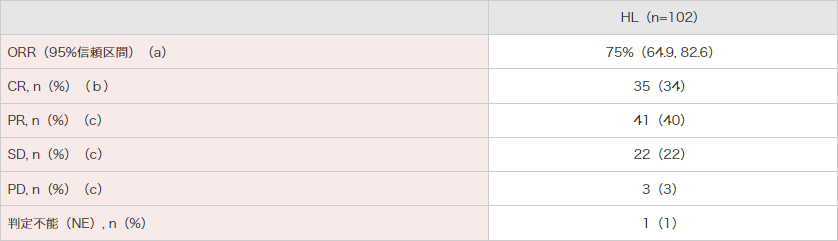
102例における主要評価項目である中央判定委員会(以下IRF)判定結果に基づくORR(CR+PR)は75%(95%信頼区間:64.9, 82.6)でした。また、副次評価項目であるCRが認められた被験者は35例(34%)でした。
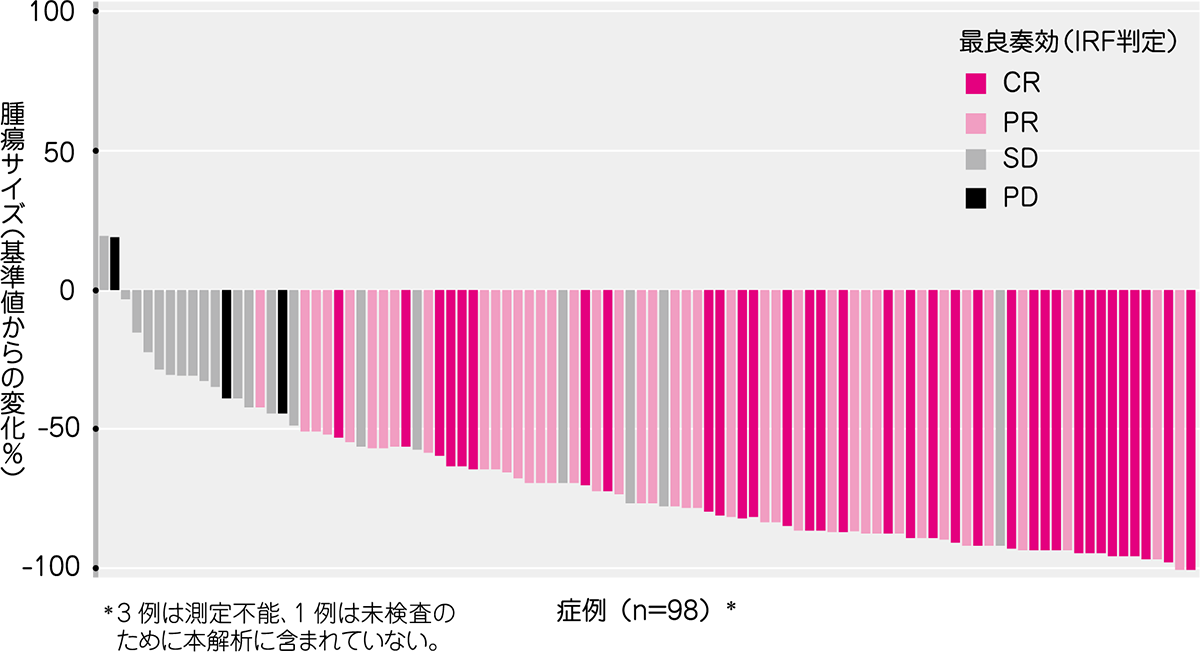
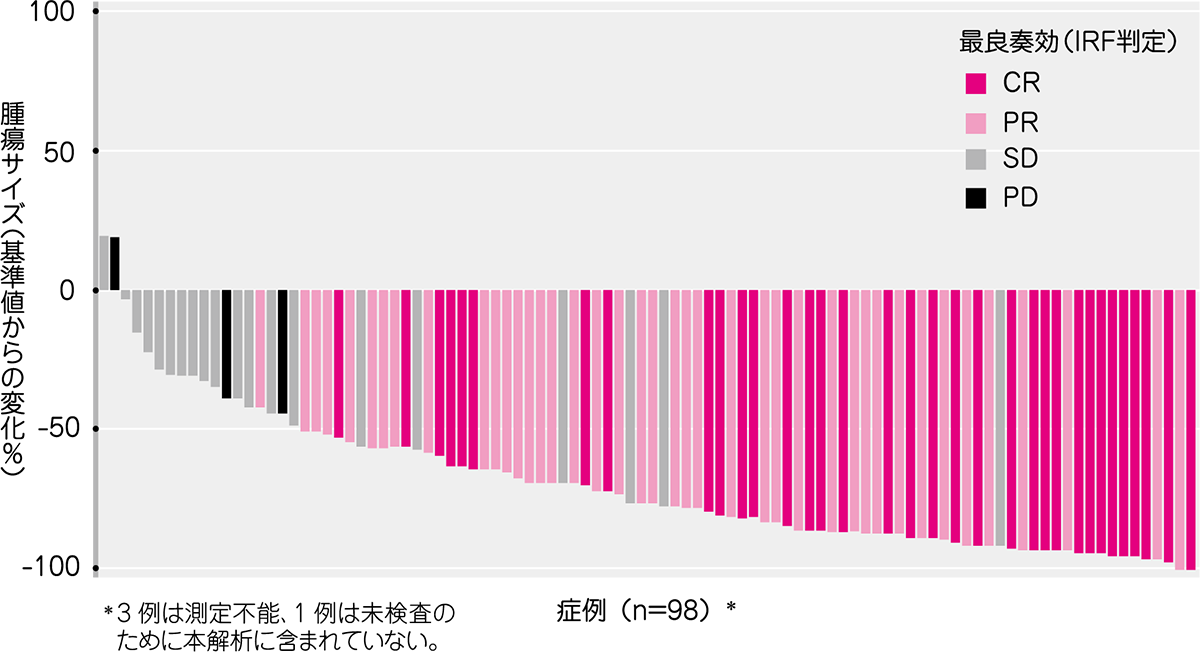
腫瘍の縮小はIRF判定が可能であった98例中96例に認められました。
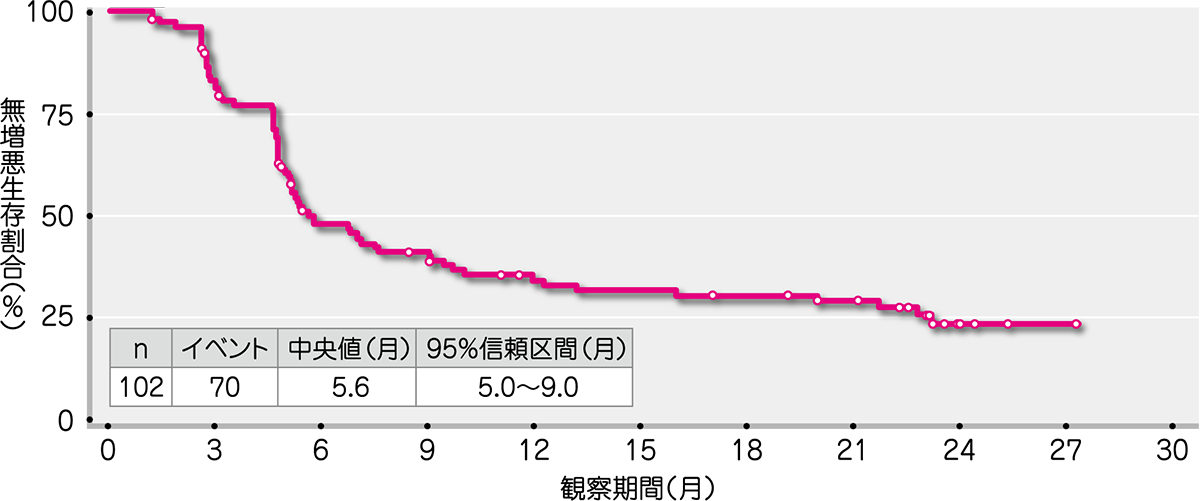
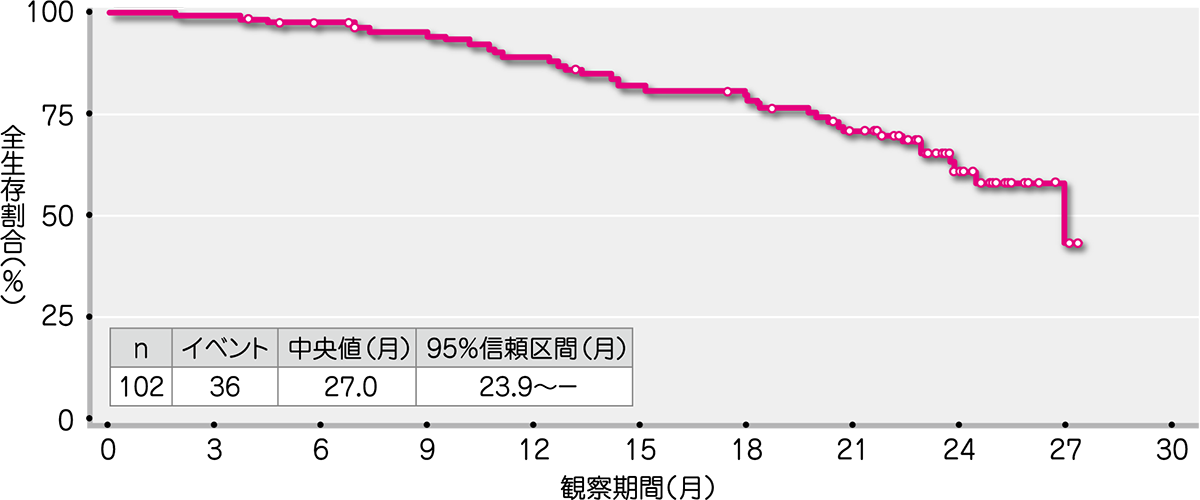
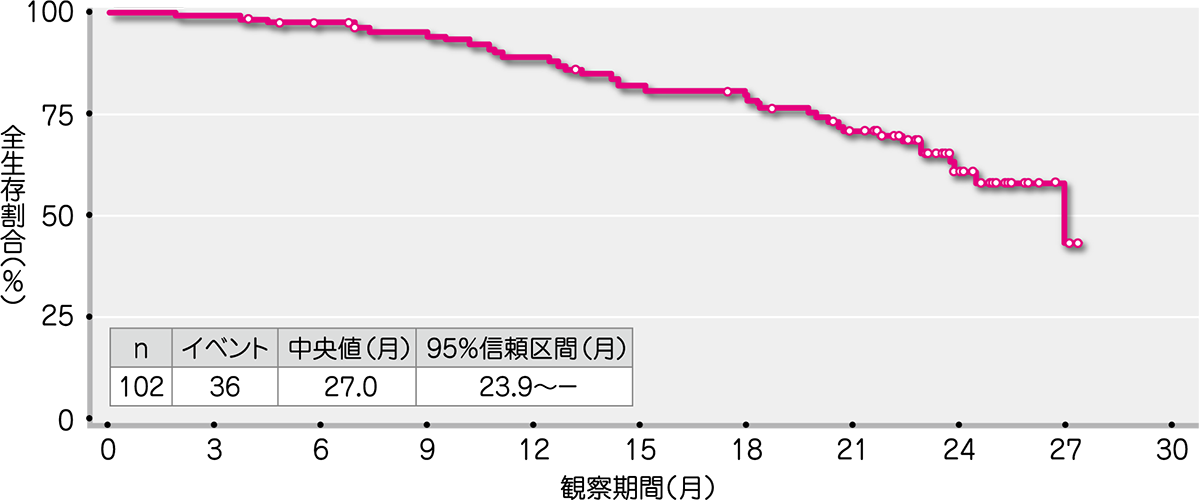
副次評価項目であるDORの中央値は6.7ヵ月(範囲:1.2~26.1ヵ月)、PFSの中央値は5.6ヵ月(範囲:1.2~27.3ヵ月)、OSの中央値は27.0ヵ月(範囲:1.8~27.3ヵ月)でした(Kaplan-Meier法による)。
● HL被験者に対する臨床的有効性(ITT解析対象集団)(IRF判定)
[主要評価項目(a)][副次評価項目(b)][その他の評価項目(c)]
● 腫瘍の最大縮小率(ITT解析対象集団)(IRF判定)[その他の評価項目]
● HL被験者におけるPFS(ITT解析対象集団)(IRF判定)[副次評価項目]
● HL被験者におけるOS(ITT解析対象集団)[副次評価項目]
安全性[副次評価項目]
副作用発現頻度は、102例中93例(91%)でした。主な副作用(20%以上)は、末梢性感覚ニューロパチー43例(42%)、悪心36例(35%)及び疲労35例(34%)でした(承認時)。
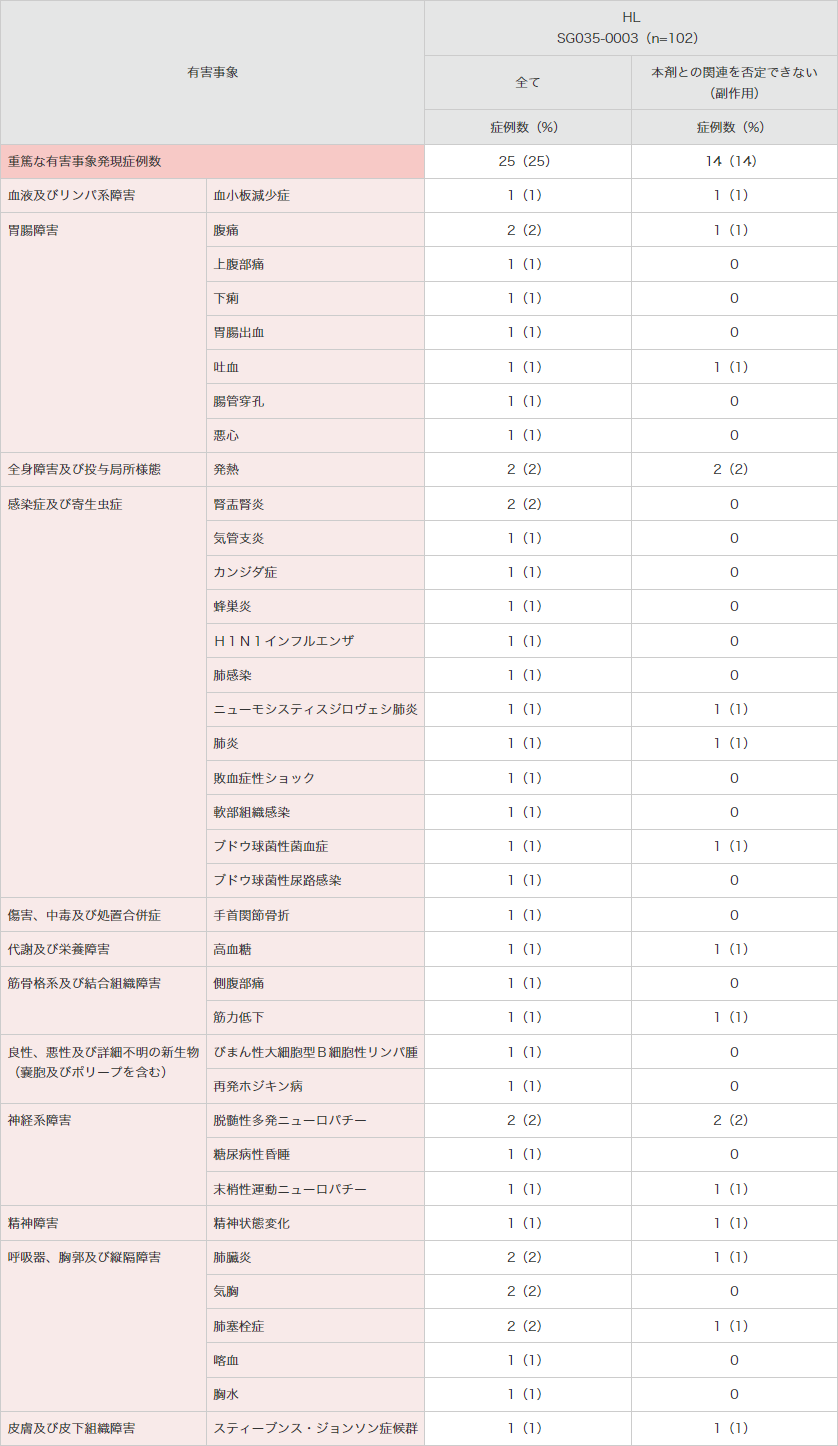
重篤な有害事象は25例(25%)に認められ、下表のとおりでした。
投与中止に至った有害事象は20例(20%)でした。有害事象の内訳は、末梢性感覚ニューロパチー6例、末梢性運動ニューロパチー3例、再発ホジキン病2例、関節痛、脱髄性多発ニューロパチー、アレルギー性皮膚炎、筋力低下、骨髄異形成症候群、肺臓炎、肺塞栓症、スティーブンス・ジョンソン症候群、咽喉絞扼感〔以上、各1例〕でした。
治験期間中の死亡例(治験治療薬の最終投与後30日以内に認められた死亡)は報告されませんでした。
なお、18例(18%)で16サイクルの投与が行われ、投与サイクルの中央値は9サイクル(範囲:1~16サイクル)でした。
● 海外第Ⅱ相試験(SG035-0003 試験)における副作用*(安全性解析対象集団)
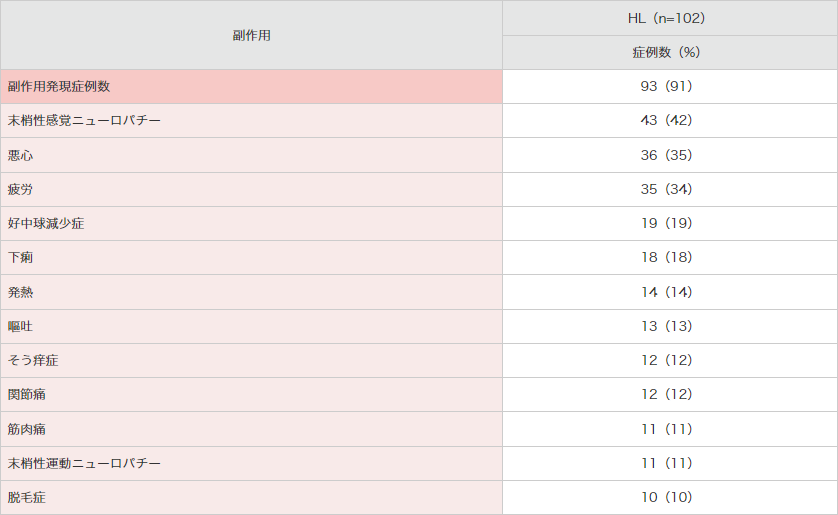
MedDRA Ver.13.0により集計。SG035-0003試験。*10%以上発現した副作用を示した。
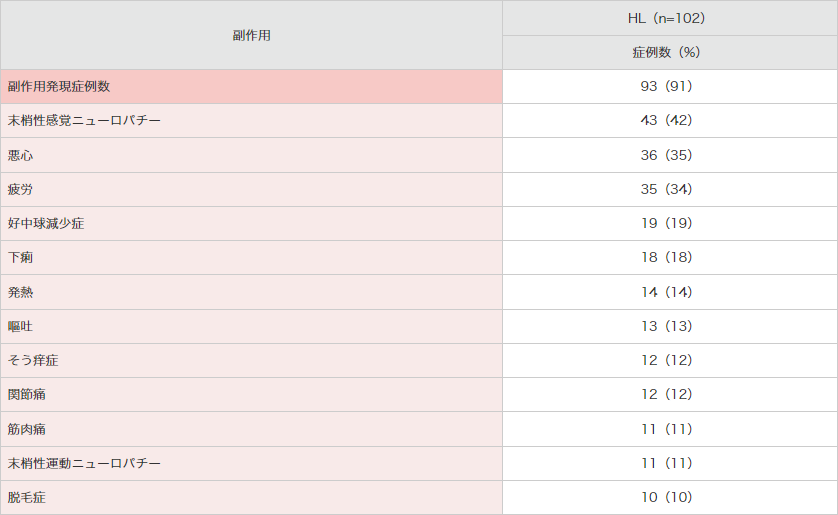
MedDRA Ver.13.0により集計。SG035-0003試験。*10%以上発現した副作用を示した。
● 海外第Ⅱ相試験(SG035-0003試験)におけるGrade 3以上の有害事象(安全性解析対象集団)
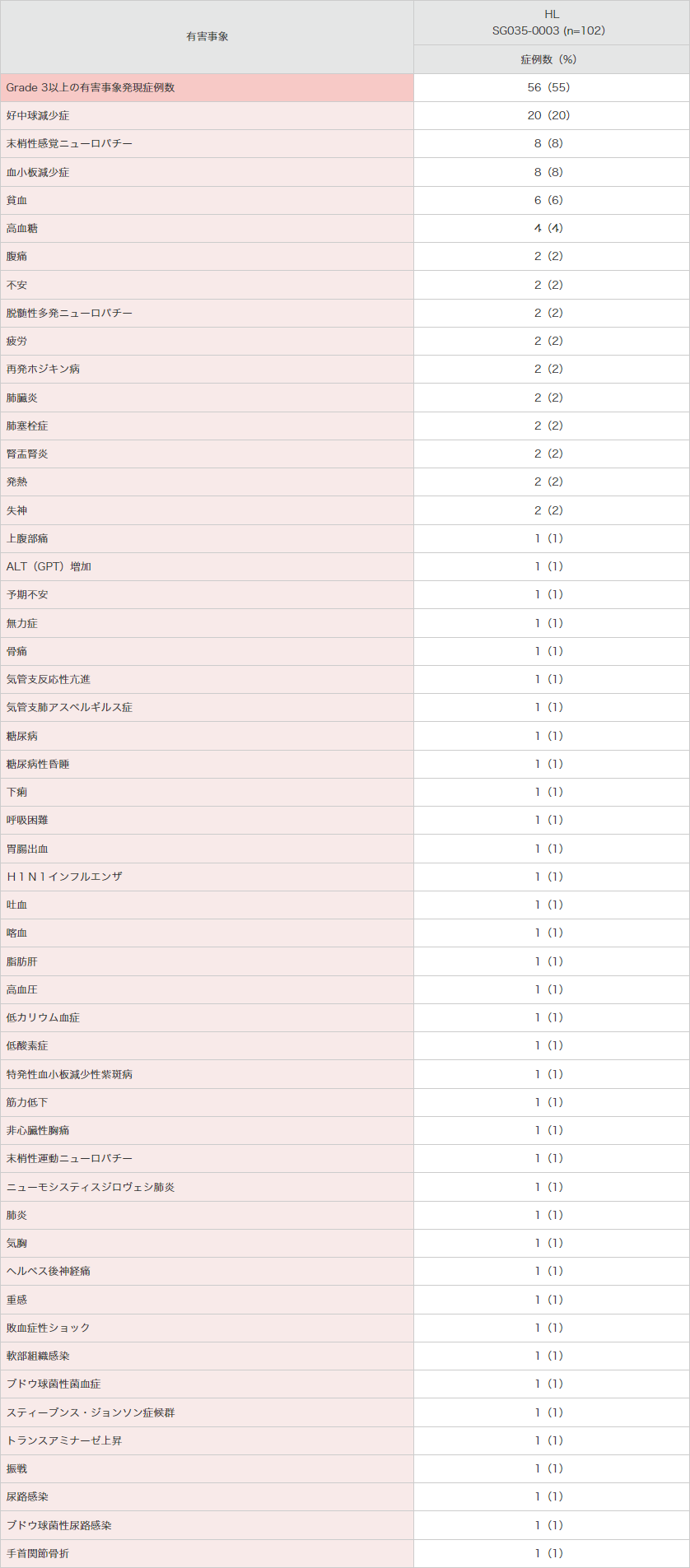
MedDRA Ver.13.0、NCI-CTCAE Ver.3.0により集計。
SG035-0003試験。
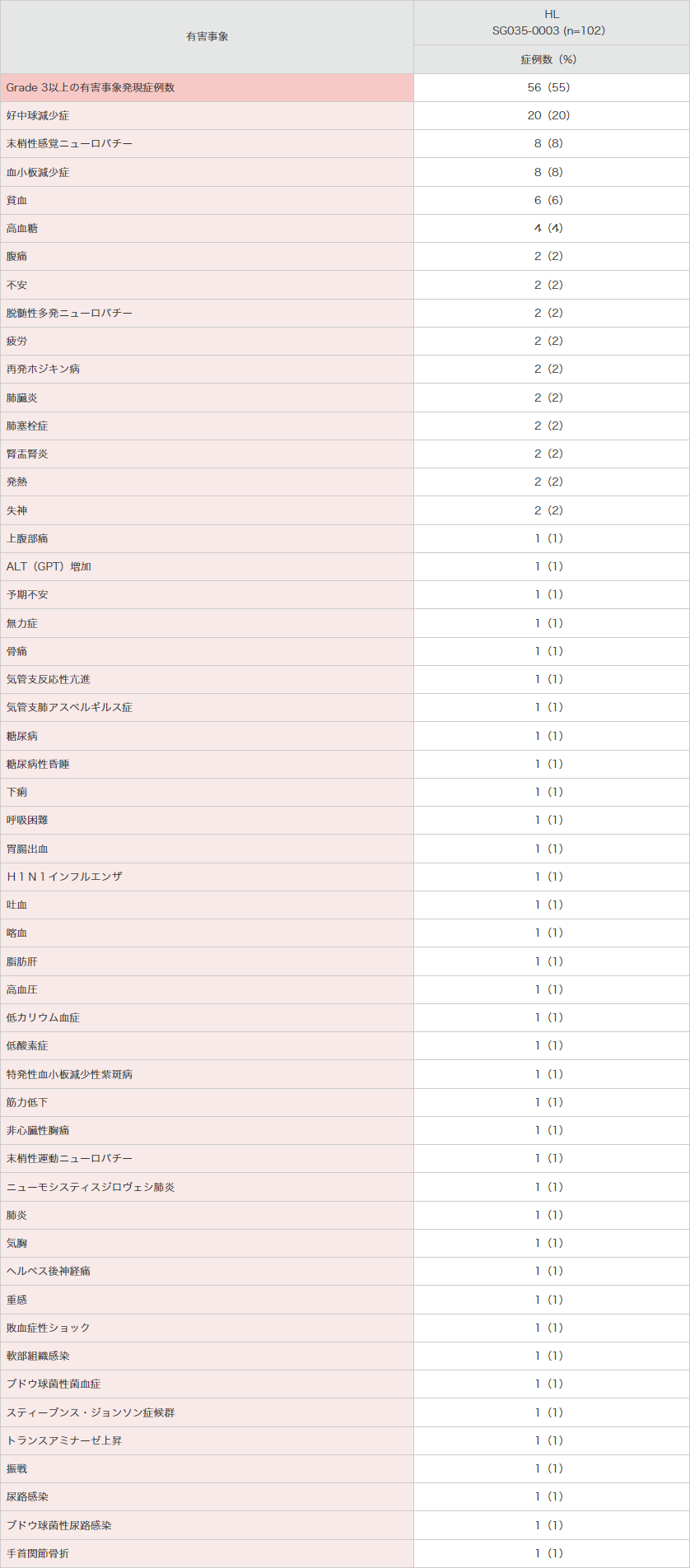
MedDRA Ver.13.0、NCI-CTCAE Ver.3.0により集計。
SG035-0003試験。
● 海外第Ⅱ相試験(SG035-0003試験)における重篤な有害事象(安全性解析対象集団)
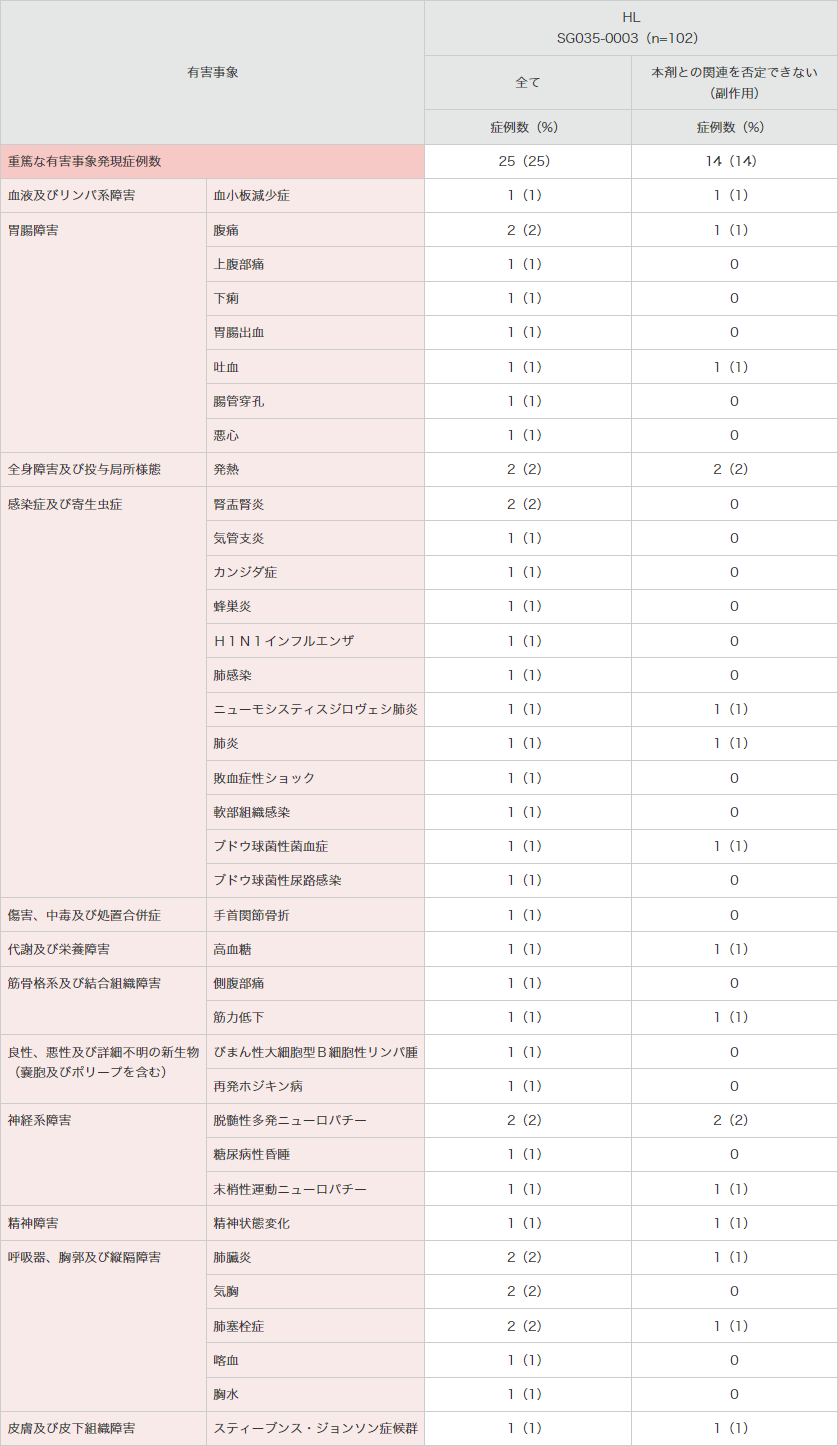
MedDRA Ver.13.0、NCI-CTCAE Ver.3.0により集計。
SG035-0003試験。
MedDRA Ver.13.0、NCI-CTCAE Ver.3.0により集計。
SG035-0003試験。
長期成績を確認する
<参考>
海外第Ⅱ相試験(SG035-0003試験)の約5年追跡調査結果
Chen R, et al.: Blood. 2016; 128(12):1562-1566.
本試験は、Seattle Genetics社(現・seagen社)とMillennium Pharmaceuticals社(現・武田薬品工業株式会社)の資金提供により実施された。
本論文の著者のうちそれぞれ2名、1名は同社の社員で、試験計画、解析、執筆等の支援を受けている。
著者に同社より研究支援、謝礼金等を受領している者が含まれる。
追跡調査概要


経過観察期間
ブレンツキシマブ ベドチンの治療終了以降から約5年経過した終了時に、102例中15例が寛解を維持していました。うち、6例が地固め療法として同種造血幹細胞移植を受け、9例はブレンツキシマブ ベドチンによる治療終了後、新たな治療は受けていませんでした。この15例の経過観察期間の中央値は69.5ヵ月(範囲:66.5~72.9ヵ月)でした。また登録された全102例の経過観察期間の中央値は、35.1ヵ月(範囲:1.8~72.9ヵ月)でした。
末梢神経障害(PN)の発現状況注)[副次評価項目]
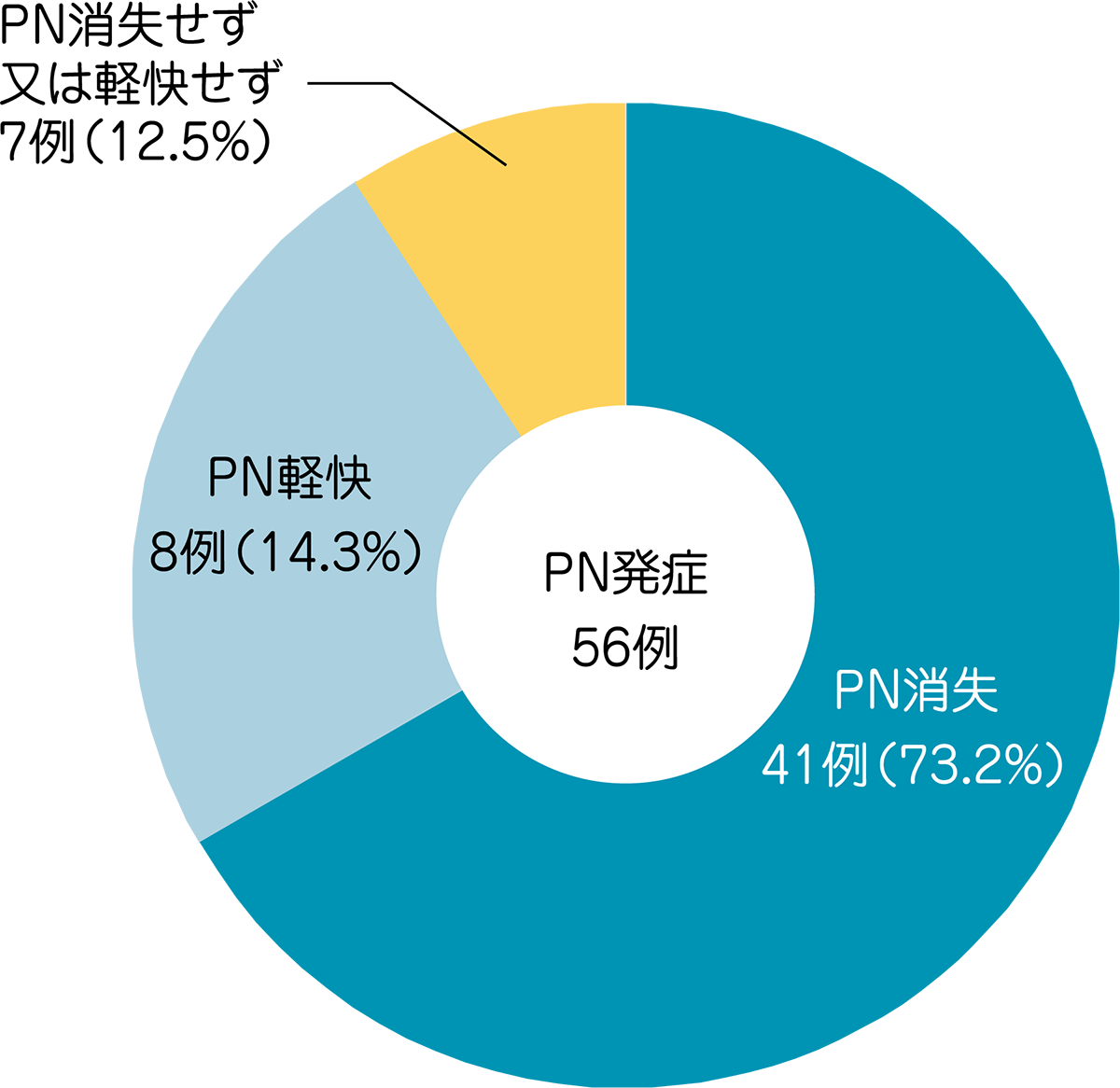
被験者102例中56例(55%)にPNが発現しました。PNの消失と軽快について、長期にわたり約3年まで経過観察を行いました。最終評価時点でPNを発現した56例中49例(88%)がPNの消失又は軽快を示し、7例(12.5%)はPN消失又は軽快しませんでした。
最終の経過観察時までPNが残存していた15例中11例はGrade 1であり、4例がGrade 2でした。
●HL被験者におけるPNの発現状況
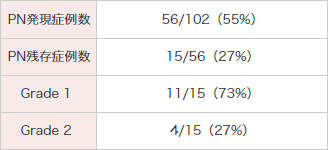
MedDRA Ver.13.0、CTCAE Ver.3.0により集計。
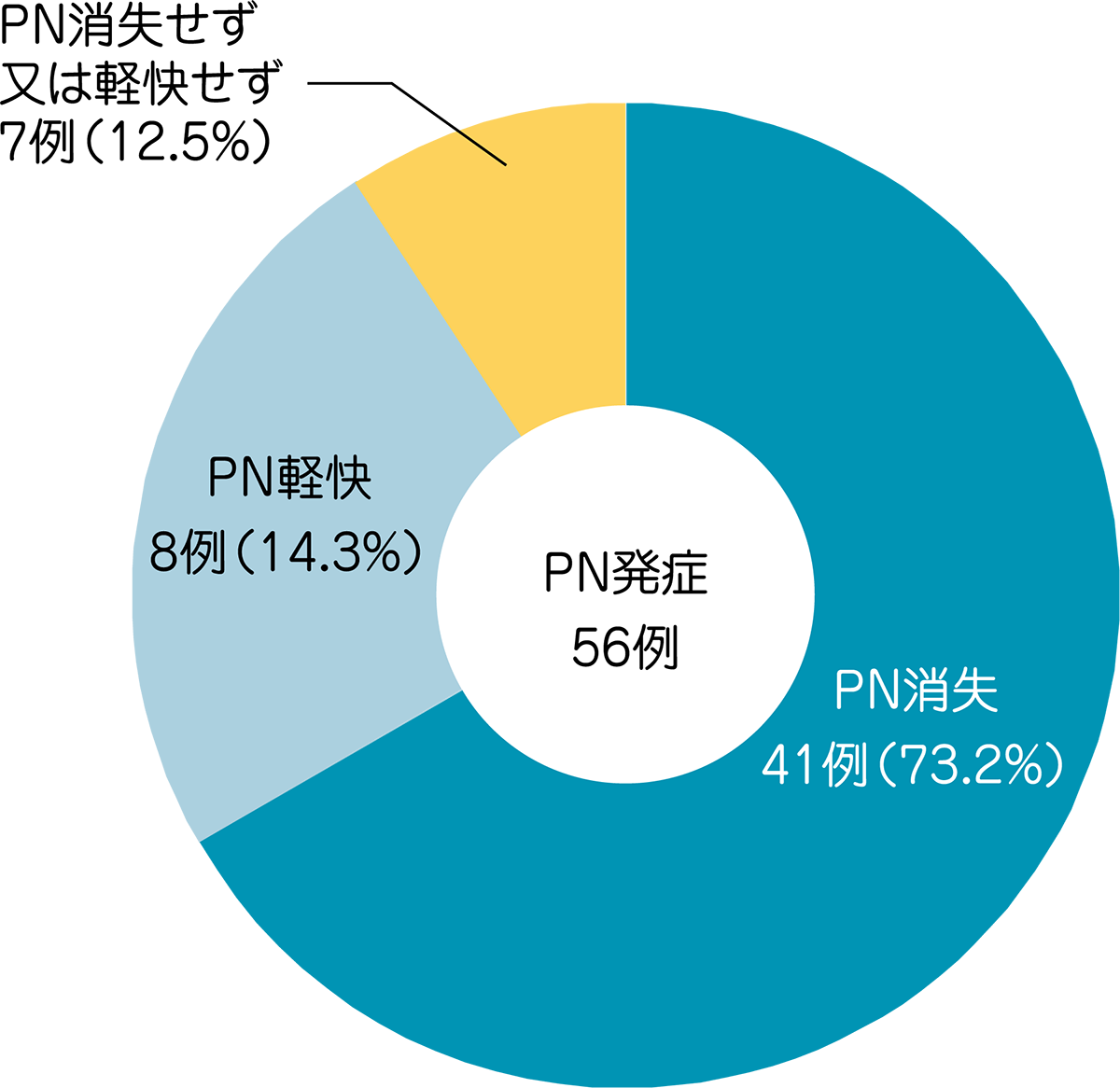
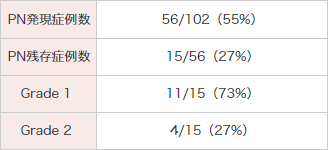
MedDRA Ver.13.0、CTCAE Ver.3.0により集計。
注) 副次評価項目である安全性に関して、ブレンツキシマブ ベドチンの医薬品リスク管理計画の【重要な特定されたリスク】の一つであるPNを取り上げました。