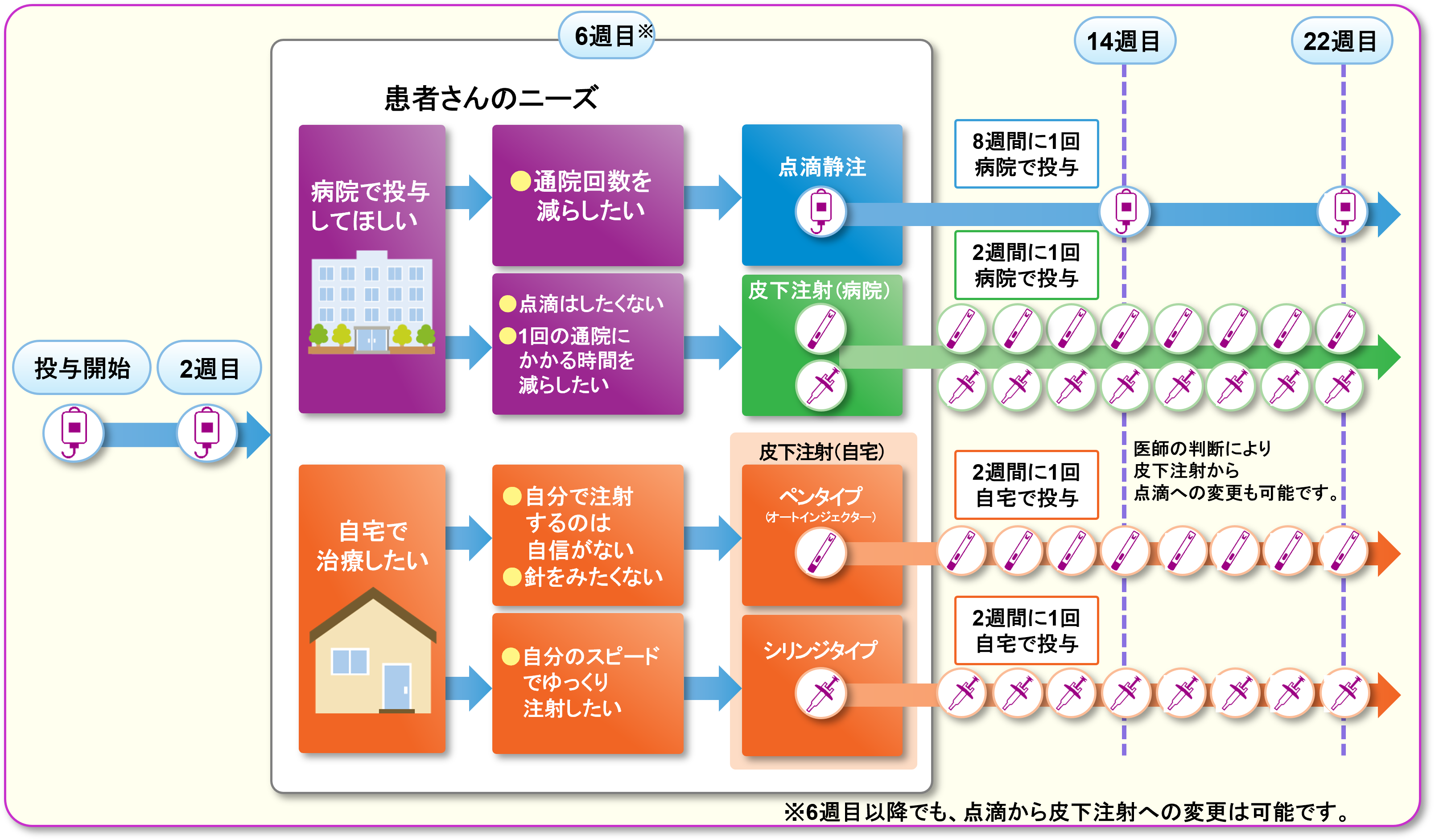
基本情報
製品・疾患紹介動画
UC関連資料
感染症等の副作用の発現に留意し、十分な観察を行いながら投与してください。一般的に高齢者では生理機能(免疫機能等)の低下が認められていることから電子添文等への記載を設定しています。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
電子添文では、生ワクチンは「併用注意(併用に注意すること)」に設定されています。
本剤は免疫調節作用を有することから、生ワクチンの接種に起因する感染症発現のリスクが上昇するおそれがあるため設定しています。
また、外国人健康成人を対象とした海外臨床試験において、本剤を投与した被験者では、経口不活化コレラ毒素ワクチンに対する適応免疫応答の減弱が報告されています。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
中等症から重症の日本人潰瘍性大腸炎患者さんを対象とした国内第Ⅲ相臨床試験又は中等症から重症の日本人クローン病患者さんを対象とした国内第Ⅲ相臨床試験で、エンタイビオ点滴静注用300mgを継続的に投与された患者さんのうち、いずれかの時点で抗体産生が認められた患者さんの割合は3.0%(8/269例)でした。
中等症から重症の外国人潰瘍性大腸炎患者さんを対象とした海外第Ⅲ相臨床試験又は中等症から重症の外国人クローン病患者さんを対象とした海外第Ⅲ相臨床試験で、エンタイビオ点滴静注用300mgを継続的に投与された患者さんのうち、いずれかの時点で抗体産生が認められた患者さんの割合は6.0%(86/1,427例)でした。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
エンタイビオ点滴静注用300mgの承認時までの国内臨床試験において、本剤を投与された437例中3例(0.7%)で「良性、悪性および詳細不明の新生物(嚢胞およびポリープを含む)」の副作用が認められており、骨髄異形成症候群1例(0.2%)、前立腺癌1例(0.2%)、甲状腺腺腫1例(0.2%)でした。
また、海外臨床試験において本剤を投与された1,922例中3例(0.2%)で「良性、悪性および詳細不明の新生物(嚢胞およびポリープを含む)」の副作用が認められており、結腸癌1例(0.1%)、メラノサイト性母斑1例(0.1%)、皮膚乳頭腫1例(0.1%)でした。
(参考資料)
エンタイビオ点滴静注用300mg インタビューフォーム
国内第Ⅲ相試験、海外第Ⅲ相試験及び国内第Ⅰ相反復投与試験においてエンタイビオ点滴静注用300mgを投与された患者さんのうち、本剤との因果関係が「関連あり」である「過敏性反応を含むInfusion reaction*」の発現頻度は3.6%(85/2,359例)でした。
*治験担当医師が注入に伴う反応と判断した事象
(参考資料)
エンタイビオ点滴静注用300mg インタビューフォーム
国内第Ⅲ相試験、海外第Ⅲ相試験及び国内第Ⅰ相反復投与試験においてエンタイビオ点滴静注用300mgを投与された患者さんのうち、本剤との因果関係が「関連あり」である「感染症および寄生虫症」の発現頻度は11.1%(263/2,359例)でした。
また、このうち重篤な有害事象の発現頻度は1.4%(32/2,359例)でした。
(参考資料)
エンタイビオ点滴静注用300mg インタビューフォーム
α4β7インテグリンはメモリーTリンパ球表面に発現します。α4β7インテグリンは、消化管粘膜の血管内皮細胞表面に発現する粘膜アドレシン細胞接着分子-1(MAdCAM-1)に接着することによって消化管粘膜及び腸管関連リンパ系組織へのリンパ球浸潤を媒介します。ベドリズマブはα4β7インテグリンに特異的に結合し、α4β7インテグリンと主に消化管に発現するMAdCAM-1 との結合を阻害する一方で、中枢神経、皮膚等多くの臓器に発現する血管細胞接着分子-1(VCAM-1)との結合は阻害しませんでした。(in vitro)
MAdCAM-1(マドキャム-ワン):Mucosal Addressin Cell Adhesion Molecule-1
VCAM-1(ブイキャム-ワン):Vascular Cell Adhesion Molecule-1
(参考資料)
エンタイビオ点滴静注用300mg インタビューフォーム
電子添文に「本剤投与に先立って結核に関する十分な問診及び胸部レントゲン検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。」と記載されています。
また、本剤投与中も、胸部レントゲン検査等の適切な検査を定期的に行うなど結核の発現には十分に注意し、患者さんに対し、結核を疑う症状が発現した場合(持続する咳、発熱等)には速やかに医師に連絡するよう説明してください。なお、結核の活動性が確認された場合には本剤を投与しないでください。
なお、以下のいずれかの患者さんには、原則として本剤の開始前に適切な抗結核薬を投与してください。
・胸部画像検査で陳旧性結核に合致するか推定される陰影を有する患者さん
・結核の治療歴(肺外結核を含む)を有する患者さん
・インターフェロン-γ遊離試験やツベルクリン反応検査等の検査により、既感染が強く疑われる患者さん
・結核患者さんとの濃厚接触歴を有する患者さん
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
1) バイアルからフリップオフキャップを取り外し、ゴム栓部をアルコール綿で拭き取ります。ゴム栓の中心を通してバイアル内に18〜25ゲージ針付きのシリンジを挿入し、気泡が生じないように日局注射用水、日局生理食塩液又は日局L-乳酸ナトリウムリンゲル液4.8mLをバイアルの壁面に伝って流れるように注入します。
2) バイアルを15秒以上ゆっくりと回転させ、凍結乾燥製剤を溶解させます。その際にバイアルを振盪させたり上下に反転させないでください。気泡を消散させるために、バイアルを約20分間静置してください。20分後に溶解が不十分であった場合には、更に回転させた後に10分間静置してください。
3) 溶解した薬液は澄明又は乳白光があり、無色から帯褐黄色であることを確認します。変色や粒子が認められた場合には使用しないでください。
4) 溶解後は速やかに希釈してください。やむを得ず溶解後速やかに希釈しない場合には、2~8℃で保存し、溶解後8時間以内に希釈してください。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
1) 溶解した薬液を抜き取る前にバイアルを静かに3回上下反転させ、確実に混合します。溶解した薬液5mLをバイアルから18〜25ゲージ針付きのシリンジで抜き取り、日局生理食塩液100mLで希釈します。バッグを数回上下に反転させ、確実に混合してください。他剤と混和しないでください。
2) エンタイビオ点滴静注用300mgは保存剤を含有していないため、希釈後は速やかに使用してください。やむを得ず希釈後速やかに投与開始しない場合には、常温保存では凍結乾燥製剤の溶解後12時間以内、又は2〜8℃(凍結させない)での保存では凍結乾燥製剤の溶解後24時間以内に投与してください。未使用分は廃棄してください。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
電子添文に「他剤と混和してはならない。」と記載されています。また、他剤との配合変化を検討した成績はありません。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
妊婦又は妊娠している可能性のある女性には、治療上の妊婦に対する有益性が胎児への危険性を上回ると判断される場合にのみ投与してください。動物実験(サル)で妊娠期間中に本剤を投与した母動物の分娩後に乳仔の血清中から本剤が検出されました。
なお、国内及び海外において、妊婦の安全性を検討した臨床試験や妊婦を組み入れた臨床試験は実施しておらず、本剤を妊婦に投与した際の安全性は確立していません。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。ヒトで乳汁中への本剤の移行が報告されています。本剤の哺乳中の児への影響は不明です。
なお、国内及び海外において、授乳時の安全性を検討した臨床試験や授乳婦を組み入れた臨床試験は実施しておらず、本剤を授乳婦に投与した際の安全性は確立していません。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していません。
低出生体重児、新生児、乳児、幼児又は小児における安全性は確立していないことから電子添文等への記載を設定しています。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
エンタイビオ点滴静注用300mg インタビューフォーム
電子添文に「本剤と他の免疫抑制作用を有する生物製剤の併用について臨床試験は実施していないため、本剤との併用を避けること。」と記載されています。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
電子添文等ではプレメディケーション(前投薬)の規定はありません。
アナフィラキシーや重度のInfusion reactionが認められた場合には、投与を中止し、適切な処置(酸素吸入、昇圧剤、解熱鎮痛剤、副腎皮質ホルモン剤の投与等)を行うとともに、症状が回復するまで患者さんを十分に観察してください。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
電子添文にB型肝炎に関する記載はありません。
しかし、本剤は免疫反応を減弱する作用を有し、正常な免疫応答に影響を与える可能性があるため、感染症の患者さん又は感染症が疑われる患者さんは、十分に観察してください。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
電子添文等ではインラインフィルターの使用に関する規定はありません。
(参考資料)
エンタイビオ点滴静注用300mg 電子添文
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。