基本情報
|
2025年09月09日 |
|
| アジルバ錠/顆粒、ザクラス配合錠「使用上の注意」改訂のお知らせ | |
|
2024年08月29日 |
|
| アジルバ錠/顆粒「使用上の注意」改訂のお知らせ | |
|
2024年08月29日 |
|
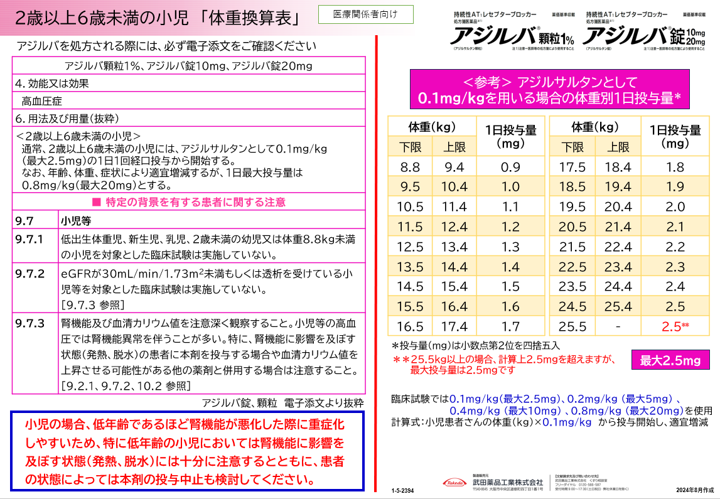
| アジルバ顆粒、アジルバ錠10mg、アジルバ錠20mgの2歳以上6歳未満の小児への用法及び用量追加のお知らせ |
製品・疾患紹介動画
次の試験を実施しています。
6歳以上16歳未満の高血圧症患者を対象とした薬物動態試験および長期投与試験を実施しています。
2歳以上6歳未満の高血圧症患者を対象とした長期投与試験を実施しています。
低出生体重児、新生児、乳児、2歳未満の幼児又は体重8.8kg未満の小児を対象とした臨床試験は実施していません。
引用:アジルバ錠、アジルバ顆粒 電子添文
臨床適用を検討する上での参考情報として、アジルバ錠、アジルバ顆粒 インタビューフォームに記載のP68をご参照ください1-3)。
(参考資料)
- アジルバ錠10mg・20mg・40mg アジルバ顆粒1% インタビューフォーム
- アジルバ錠10mg・20mg・40mg アジルバ顆粒1% 電子添文
- エビデンスに基づくCKD診療ガイドライン2018 日本腎臓学会
〈製剤共通〉
〈小児〉
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5㎎、体重50kg以上の場合には5㎎の1日1回経口投与から開始する。
なお、年齢、体重、症状により適宜増減するが、1日最大投与量は体重50kg未満の場合は20㎎、体重50kg以上の場合は40㎎とする。
〈アジルバ錠10mg、20mg、アジルバ顆粒1%〉
〈小児〉
通常、2歳以上6歳未満の小児には、アジルサルタンとして0.1mg/kg(最大2.5mg)の1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は0.8mg/kg(最大20mg)とする。
〈製剤共通〉
〈成人〉
通常、成人にはアジルサルタンとして20mgを1日1回経口投与します。なお、年齢、症状により適宜増減するが、1日最大投与量は40mgとします。
〈小児〉
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5mg、体重50kg以上の場合は5mgの1日1回経口投与から開始します。なお、年齢、体重、症状により適宜増減しますが、1日最大投与量は体重50kg未満の場合は20mg、体重50kg以上の場合は40mgとします。
〈アジルバ錠10mg、20mg、アジルバ顆粒1%〉
〈小児〉
通常、2歳以上6歳未満の小児には、アジルサルタンとして0.1mg/kg(最大2.5mg)の1日1回経口投与から開始します。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は0.8mg/kg(最大20mg)とします。
<高齢者>
高齢者の場合、低用量から投与を開始するなど慎重に投与してください。一般に過度の降圧は好ましくないとされています。脳梗塞等が起こるおそ
れがあります。
引用:アジルバ錠、アジルバ顆粒 電子添文
アジルバ錠、アジルバ顆粒 インタビューフォーム
6歳以上の小児高血圧症患者を対象とした国内臨床試験では、27例中の12例(44.4%)に臨床検査値の異常を含む副作用が認められました。
2歳以上6歳未満の小児高血圧症患者を対象とした国内臨床試験では、9例中の3例(33.3%)に副作用が認められました。
副作用の発現状況はアジルバ錠、アジルバ顆粒 インタビューフォームに記載のP85をご参照ください。
引用:アジルバ錠、アジルバ顆粒 インタビューフォーム
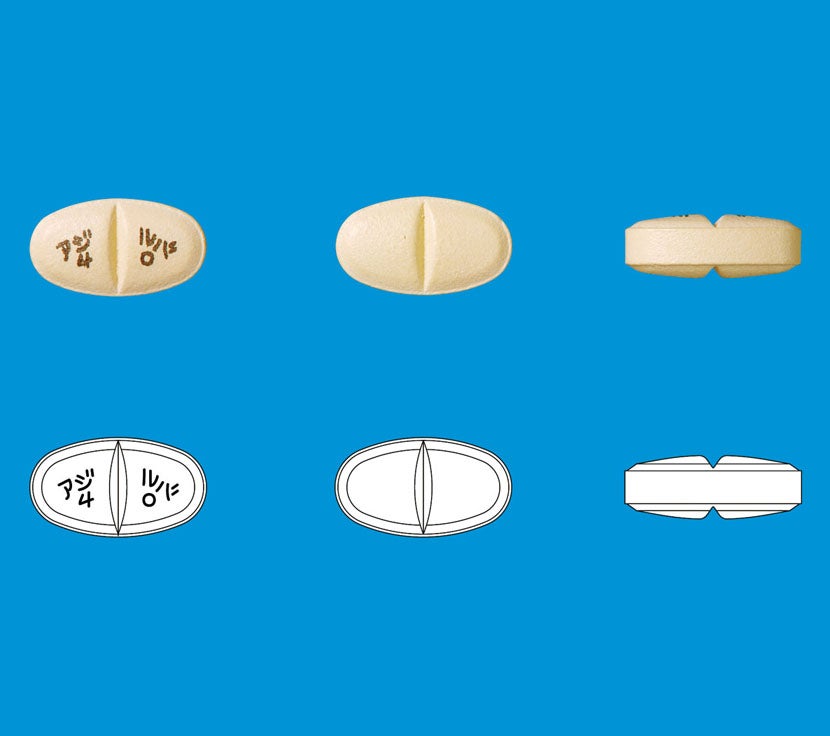
◇アジルバ錠10mg
割線がありません。
半錠にした際の含量均一性を担保できないため半分に割ることはお勧めしていません。なお、「半錠の安定性」は検討していません。
◇アジルバ錠20mg
両面割線入りの錠剤であり、半錠にすることは可能です。
◇アジルバ錠40mg
両面割線入りの錠剤であり、半錠にすることは可能です。
(参考資料)
アジルバ錠10mg・20mg・40mg アジルバ顆粒1% インタビューフォーム
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。