基本情報
|
2025年02月04日 |
|
| ボンベンディ溶解器上蓋の印に関するご案内 | |
|
2024年03月13日 |
|
| アディノベイト静注用キット、アドベイト静注用キット、ボンベンディ静注用_電子化された添付文書改訂のお知らせ |
製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
ボンベンディ静注用1300による治療を受けられる患者さんへ
ボンベンディ静注用1300の電子添文では、腎機能障害患者、透析患者に対する注意喚起の記載はありません1)。
ボンベンディ静注用1300は腎機能障害によっておこるリスクの情報はありませんが、安全性の検証試験も行われていません。透析膜や腹膜透析を介したボンベンディ静注用1300の消失に関して検討データがありません。
参考)
ボンベンディ静注用1300の代謝はデータがありませんが身体の構成成分であるタンパク質として分解、代謝されるものと取り扱われています2)。
(参考資料)
- ボンベンディ静注用1300 電子添文
- ICH-S6 バイオテクノロジー応用医薬品 バイオテクノロジー応用医薬品の非臨床における安全性評価(4.2.3 代謝)https://www.pmda.go.jp/files/000156471.pdf(閲覧日:2023年8月30日)
肝機能障害を有する患者さんに対する投与について特別な注意喚起は電子添文に設定されていません1)。
(参考資料)
- ボンベンディ静注用1300 電子添文
ボンベンディ静注用1300の電子添文では、高齢者については「患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。」と注意喚起されています1)。
(参考資料)
- ボンベンディ静注用1300 電子添文
ボンベンディ静注用1300の電子添文では、小児については「小児等を対象とした臨床試験成績は得られていない。」と記載されています1)。
(参考資料)
- ボンベンディ静注用1300 電子添文
ボンベンディ静注用1300の電子添文「7.2 出血時の止血治療と管理」を以下に示します。
7.2.1 軽度出血及び大出血治療時の推奨用量を以下に示す。
軽度出血及び大出血治療時の推奨用量
| 出血の種類 | 初回投与量 | 初回以降の投与量 (又は、臨床的に必要とされる期間) |
| 軽度出血 (鼻出血、口腔出血、月経過多など) | 40~50IU/kg | 40~50IU/kgを8~24時間ごと |
| 大出血 (重度又は難治性の鼻出血、月経過多、消化管出血、中枢神経系の外傷、関節出血、外傷性出血など) | 50~80IU/kg | 40~60IU/kgを約2~3日間、8~24時間ごと |
7.2.2 出血事象に対し、FⅧ:Cが40%未満あるいは不明の場合は、本剤を初回投与後、10分以内にFⅧ製剤を投与すること。
7.2.3 初回投与後のvon Willebrand因子リストセチンコファクター活性
(VWF:RCo)及びFⅧ:Cの補充レベルは、それぞれ、60%超及び40%超を達成するようにすること。大出血事象の場合、臨床的に必要とされる期間、VWF:RCoのトラフ値50%超を維持すること。
6. 用法及び用量
本剤を添付の溶解液10mLで溶解し、4mL/分を超えない速度で緩徐に静脈内に注射する。
通常、18歳以上の患者には、体重1kg当たり40~80国際単位を投与するが、患者の状態に応じて適宜増減する。
FⅧ:C: 血漿第Ⅷ因子活性
(参考資料)
- ボンベンディ静注用1300 電子添文
患者さんの血漿第Ⅷ因子活性(FⅧ:C)を測定1)し、FⅧ:Cが40%未満2)の患者さんには、ボンベンディ静注用1300を投与します。
フォン・ヴィレブランド因子(von Willebrand factor: VWF)は第Ⅷ因子(FⅧ)の安定化機能があり、von Willebrand病患者さんではさまざまな程度でFⅧ:Cの低下が起きています3)。このためvon Willebrand病患者さんにおける出血傾向の抑制にはそれぞれの患者さんのFⅧ:Cに応じてボンベンディ静注用1300投与とともにFⅧ製剤を併用投与することがあります。
また、出血時の止血では、FⅧ:Cが不明な患者さんに対しても、ボンベンディ静注用1300初回投与後のFⅧ:Cの補充レベルが40%を超えるようにFⅧ製剤を投与します。
(参考資料)
- ボンベンディ静注用1300 電子添文
- 欧州医薬品庁の血漿由来von Willebrand因子の製品概要ガイドラインhttps://www.ema.europa.eu/en/documents/assessment-report/veyvondi-epar-public-assessment-report_en.pdf(閲覧日:2023年8月30日)
- 志田 泰明, 野上 恵嗣: 日本血栓止血学会誌. 2015; 26(1): 49-56.
ボンベンディ静注用1300の投与は、止血障害の治療経験をもつ医師のもとで開始します。在宅自己注射は、医師がその妥当性を慎重に検討し、患者さん又はその家族が適切に使用可能と判断した場合にのみ適用することが認められています1)。
8. 重要な基本的注意
8.5 本剤の在宅自己注射は、医師がその妥当性を慎重に検討し、患者又はその家族が適切に使用可能と判断した場合にのみ適用すること。本剤を処方する際には、使用方法等の患者教育を十分に実施した後、在宅にて適切な治療が行えることを確認した上で、医師の管理指導のもとで実施すること。また、患者又はその家族に対し、本剤の注射により発現する可能性のある副作用等についても十分に説明し、在宅自己注射後に何らかの異常が認められた場合や注射後の止血効果が不十分な場合には、速やかに医療機関へ連絡するよう指導すること。適用後、在宅自己注射の継続が困難な場合には、医師の管理下で慎重に観察するなど、適切な対応を行うこと。
参考)
(11) ボンベンディ静注用 13002)
① 本製剤は、遺伝子組換えヒト von Willebrand 因子製剤であり、本製剤の自己注射を行っている患者に対して指導管理を行った場合は、医科点数表区分番号「C101」在宅自己注射指導管理料を算定できるものであること。
② 本製剤は針及び注入器付きの製品であるため、医科点数表区分番号「C101」在宅自己注射指導管理料を算定する場合、医科点数表区分番号「C151」注入器加算及び「C153」注入器用注射針加算は算定できないものであること。
(参考資料)
- ボンベンディ静注用1300 電子添文
- 「使用薬剤の薬価(薬価基準)の一部改正等について」厚生労働省保険局医療課通知、保医発0519第3号 (令和2年5月19日)
https://www.ssk.or.jp/shinryohoshu/kankeitsuuchi/kankeitsuuchi_r02.files/yakuzai_r02_020519_1.pdf(閲覧日:2023年8月30日)
2つの臨床試験における中和抗体(インヒビター)の出現については以下の通りです。
① 国際共同第Ⅲ相試験(071001試験)
フォン・ヴィレブランド因子(von Willebrand factor:VWF)に対する全抗体及び中和抗体の出現は認められませんでした。血液凝固第Ⅷ因子(FVIII)に対する中和抗体の出現は認められませんでした1)。
CHO由来タンパク質、マウスIgG及び遺伝子組換えフューリンに対する抗体の出現は認められませんでした2)。
② 海外第Ⅲ相試験(071101試験)(外国人データ)
3型フォン・ヴィレブラン病(VWD)患者1例において抗VWF結合・非中和抗体の出現が認められました。VWF又はFVIIIに対する中和抗体が出現した被験者は報告されませんでした1)。
CHO由来タンパク質、マウスIgG及び遺伝子組換えフューリンに対する抗体の出現は認められませんでした2)。
① 国際共同第Ⅲ相試験(071001試験)2)
VWD患者(37例:日本人3例を含む)の出血事象に対するrVWF+rFVIII投与及びrVWF単独投与の止血効果、安全性及び忍容性の評価及び健康に関連した生活の質の変化を評価した試験
② 海外第Ⅲ相試験(071101試験)(外国人データ)2)
大手術又は小手術を受ける18歳以上の遺伝性かつ重度のVWD患者(15例)に、rVWFをrFVIIIと併用投与したとき又はrVWFを単独投与したときの全般的止血効果及び安全性を評価した試験
参考)ボンベンディ静注用1300に係る医薬品リスク管理計画書3)
| 重要な潜在的リスク |
| インヒビターの発生 |
重要な潜在的リスクとした理由: ・血漿分画製剤を投与された患者におけるVWFに対するインヒビターの発現は稀であるが重篤な合併症であり、von Willebrand病の、主に3型の患者において5~10%に発現する1), 2)。 ・インヒビターを発生した患者で、VWF製剤の有効性が減弱又は消失することがあり、ときにアナフィラキシー反応を伴う場合がある3)。 注)von Willebrand病を有する患者を対象とした3つの臨床試験[第I相臨床試験(070701試験)及び第III相臨床試験(日本人を含む071001試験、071101試験)、80例のうち71例に承認された用量が投与された。] 1)James P, Lillicrap D, Mannucci P. Alloantibodies in von Willebrand disease. Blood. 2013; 122(5): 636-40. 2)Mannucci P, Federici A. Antibodies to von Willebrand factor in von Willebrand disease. Adv Exp Med Biol. 1995; 386: 87-92. 3)Mannucci P, Tamaro G, Narchi G, et al. Life-threatening reaction to factor VIII concentrate in a patient with severe von Willebrand disease and alloantibodies to von Willebrand factor. Eur J Haematol. 1987; 39(5): 467-70. |
(参考資料)
- ボンベンディ静注用1300 電子添文
- ボンベンディ静注用1300 インタビューフォーム
- ボンベンディ静注用1300に係る医薬品リスク管理計画書
フォン・ヴィレブランド(von Willebrand)病患者さんに対し、血漿中のフォン・ヴィレブランド因子を補い、その出血傾向を抑制します。
フォン・ヴィレブランド病患者さんの周術期の止血管理です。
4. 効能又は効果
von Willebrand病患者における出血傾向の抑制
(参考資料)
- ボンベンディ静注用1300 電子添文
ボンベンディ静注用1300では、フォン・ヴィレブランド(von Willebrand)の病型の体系的な検討は行われておりません。
ボンベンディ静注用1300の有効成分である遺伝子組換えヒトフォン・ヴィレブランド因子(recombinant von Willebrand factor: rVWF)は損傷を受けた血管内皮下基質(コラーゲンなど)への血小板粘着及び血小板凝集を介して止血を促進し、更に、止血の重要な補因子でありフィブリン塊の形成をもたらす血液凝固第Ⅷ因子(factor Ⅷ: FⅧ)のキャリアタンパク質として、FⅧを急速なタンパク質分解から保護することで出血傾向を抑制します1)。
(参考資料)
- Stockschlaeder M, et al.: Blood Coagul Fibrinolysis. 2014; 25: 206–216.
フォン・ヴィレブランド(von Willebrand)病を有する成人患者(日本人を含む)を対象に、ボンベンディ静注用1300、50又は80IU/kgを単回静脈内投与した際の半減期t1/2の平均値±標準偏差は、50IU/kg投与時22.6±5.34時間、80IU/kg投与で19.1±4.32時間でした1)。
参考)
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
von Willebrand病を有する成人患者(日本人を含む)を対象に、本剤50又は80IU/kgを単回静脈内投与した際のPKパラメータは以下のとおりであった2)。
VWF:RCoのPK評価
| 50IU/kg(14例) | 80IU/kg(15例) | |
| t1/2(h) | 22.6±5.34 | 19.1±4.32 |
| Cl([dL/kg]/h) | 0.025±0.005 | 0.029±0.009 |
| Cmax時点のIR ([IU/dL]/[IU/kg]) | 1.9±0.41 | 2.0±0.39 |
| AUC0-inf(IU・h/dL) | 2105.4±427.51 | 2939.0±732.72 |
平均値±標準偏差
(参考資料)
- ボンベンディ静注用1300 電子添文
- 社内資料:国際共同第Ⅲ相試験(2020年3月25日承認、CTD2.7.6.2)
ボンベンディ静注用1300の国際共同第III相臨床試験(071001試験)ではフォン・ヴィレブランド(von Willebrand)病を有する成人患者にボンベンディ静注用1300、50IU/kg単独投与後のFVⅢ活性は、投与後15分後で8.0U/dL、3時間で27.0U/dL、24時間で最高値である86.0U/dLを示しました。その後は低下し、96時間で18.0U/dLを示しました1)。
(参考資料)
- 欧州医薬品庁の血漿由来von Willebrand因子の製品概要ガイドラインhttps://www.ema.europa.eu/en/documents/assessment-report/veyvondi-epar-public-assessment-report_en.pdf(閲覧日:2023年8月30日)
ボンベンディ静注用1300の製造販売承認日は2020年3月25日、薬価基準収載日は2020年5月20日、販売開始日は2020年8月17日です。
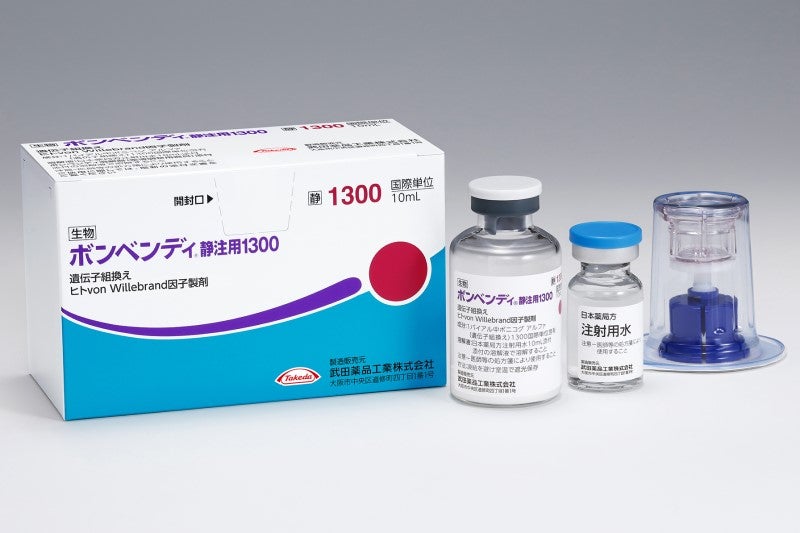
ボンベンディ静注用1300の箱の中には、ボンベンディ静注用1300:1300国際単位[1バイアル]、添付溶解液(日局 注射用水 10mL)[1バイアル]、ボンベンディ溶解器[1個]が入っています1)。
(参考資料)
- ボンベンディ静注用1300 電子添文
ボンベンディは、DPC包括対象外です。(出来高算定扱い)
中央社会保険医療協議会総会(第516回)令和4年2月9日(水)資料
https://www.mhlw.go.jp/stf/shingi2/0000212500_00139.html
「〇答申について」の「総-1」(P.112)
血友病等に使用する血液凝固因子製剤については、他疾患を主病とする場合の包括点数で十分な評価を得ることが困難であることから、包括対象外となっている。
現在、いわゆる「高額薬剤告示」において、「遺伝子組換えヒトvon Willebrand因子製剤(ボニコグアルファ(遺伝子組換え))」を血友病の類縁疾患であるvon Willebrand病の患者に対して使用する場合、当該患者は出来高により算定することとしているが、von Willebrand病は血友病と同様の疾病としての特徴を有することから、当該薬剤については、包括対象外として取り扱うこととする。
ボンベンディ静注用1300と血液凝固第Ⅷ因子(FⅧ)製剤との併用は、必ず投与するとの規定はありません。
電子添文では『7.1 患者の血漿第Ⅷ因子活性(FVIII:C)を測定し、必要に応じて、本剤と血液凝固第Ⅷ因子(FVIII)製剤を併用投与すること』と記載されています1)。
また、出血時の止血では、FVIII:Cが不明な患者さんあるいはVIII:Cが40%未満の患者さんには、ボンベンディ静注用1300初回投与後のFVIII:Cの補充レベルが40%超を達成するようFVIII製剤を投与します1)。
関連FAQ:用法・用量
どのような患者さんにボンベンディ静注用1300と血液凝固第Ⅷ因子(FⅧ)製剤を併用投与することができますか?その根拠について教えてください。
(参考資料)
- ボンベンディ静注用1300 電子添文
出血時の止血では、ベースラインの血漿第Ⅷ因子活性(FVIII:C)が40%未満の患者さんの場合は、40%超を達成できる量の血液凝固第Ⅷ因子(FⅧ)製剤を投与すること、ベースラインのFVIII:Cが不明な患者さんの場合は「ボンベンディ静注用1300を初回投与後、10分以内にFVIII製剤を投与すること。」以上の規定はありません。ただし、初回投与後のFVIII:Cの補充レベルは40%を達成するよう規定されています1)。
緊急手術の場合は手術の1時間前にFVIII:Cが適切な止血レベルまで上昇するよう投与量を調節します1)。
参考)
7.3 周術期の止血管理1)
7.3.1 手術前に本剤及び必要に応じFⅧ製剤を投与すること。用量は、術中及び術後の過度な出血を予防するための、血漿中VWF:RCo及びFⅧ:Cの推奨目標値から算出する。手術の種類ごとの推奨目標ピーク値は以下のとおり。
| 手術の種類 | 血漿中目標ピーク値 | |
| VWF:RCo(%) | FⅧ:C(%) | |
| 小手術 | 50~60 | 40~50 |
| 大手術 | 100 | 80~100 |
7.3.3 FⅧ:Cを目標値まで上昇させるために、FⅧ製剤の追加投与が必要となることがある。用量の算出は、FⅧ製剤のIR*及び電子添文に基づくこと。
*上昇回収率(IR):患者の既存の薬物動態(PK)データより算出する。
(参考資料)
- ボンベンディ静注用1300 電子添文
血液凝固第Ⅷ因子(FⅧ)製剤を用いるボンベンディ静注用1300の臨床試験ではルリオクトコグ アルファ(遺伝子組換え)を用いています1)。
(参考資料)
- ボンベンディ静注用1300社内資料:国際共同第Ⅲ相試験(2020年3月25日承認、CTD2.7.6.2)
https://www.pmda.go.jp/drugs/2020/P20200417002/index.html
- ボンベンディ静注用1300社内資料:国際共同第Ⅲ相試験(2020年3月25日承認、CTD2.7.6.2)
日本血栓止血学会からフォン・ヴィレブランド(von Willebrand)病の診療ガイドライン2021年版が発刊されています。ボンベンディ静注用1300はフォン・ヴィレブランド因子(VWF)含有濃縮製剤の一つとして記載があります(5-3.遺伝子組み換えvon Willebrand因子製剤:rVWF製剤)1)。
(参考資料)
- von Willebrand病の診療ガイドライン作成委員会: von Willebrand病の診療ガイドライン2021年版. 血栓止血誌. 2021; 32: 413-481.
ボンベンディ静注用1300は全例調査を実施しています。日本人での投与経験として一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施いたします1)。
(参考資料)
- ボンベンディ静注用1300 電子添文
通常、1回あたり本剤40~60IU/kgを週1~3回投与します。患者さんの状態に応じて、1回あたり80IU/kgを超えない範囲で適宜増減できます。
定期補充療法中に破綻出血が発現し、内因性FⅧ:Cが40%未満又は不明な場合には、本剤投与後にFⅧ製剤を併用投与してください。
2022年3月追記事項
7.4.1 通常、1回あたり本剤40~60IU/kgを週1~3回投与する。患者の状態に応じて、1回あたり80IU/kgを超えない範囲で適宜増減できる。[17.1.2参照]
7.4.2 定期補充療法中に破綻出血が発現し、内因性FⅧ:Cが40%未満又は不明な場合には、本剤投与後にFⅧ製剤を併用投与すること。[7.1、7.2.2参照]
(定期補充療法に係る海外第Ⅲ相試験(071301試験)の結果に基づき設定しました。)
(参考資料)
- ボンベンディ静注用1300 電子添文
- ボンベンディ静注用1300 インタビューフォーム
各ボタンはくすりの適正使用協議会サイトにリンクします。
日本語版
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。