製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
Prostate Cancer Web Seminar -リュープリンPRO発売10周年WEB講演会 #1-
57th TV/Web Expert Conference in Urology(U-TEC)
リュープリンPRO注射用キット22.5mgの電子添文上の禁忌、慎重投与には腎機能障害患者さんは該当しません1)。
通常の用法・用量にてお使いいただけます。
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
リュープリンPRO注射用キット22.5mgの電子添文上の禁忌、慎重投与には透析患者さんは該当しません1)。
通常の用法・用量にてお使いいただけます。
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
リュープリンPRO注射用キット22.5mgの電子添文上の禁忌、慎重投与には肝機能障害を有する患者さんは該当しません1)。
通常の用法・用量にてお使いいただけます。
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
リュープリンPRO注射用キット22.5mgの注射部位は上腕部、腹部、臀部(おしり)のいずれかの皮下です1)。
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
リュープリンPRO注射用キット22.5mgの投与後の注射部位をもまないように患者さんにご説明ください。
各製剤の電子添文の適用上の注意、投与方法に以下の記載があります1)。
14. 適用上の注意1)
14.2 薬剤投与時の注意
14.2.2 皮下注射にあたっては下記の点に注意すること。[8.2参照]
(1)注射部位は上腕部、腹部、臀部の皮下とすること。
(2)注射部位は毎回変更し、同一部位への反復注射は行わないこと。
(3)注射針が血管内に入っていないことを確認すること。
(4)注射部位をもまないように患者に指示すること。
この注意は、投与部位をもむことにより、マイクロカプセルから主薬が過量に放出される可能性が懸念されることにより設定されています2)。
またリュープリン注射用PRO注射用キット22.5mgの電子添文8.重要な基本的注意に以下の記載があります1)。
8. 重要な基本的注意1)
〈効能共通〉
8.2 本剤は24週間持続性の製剤であり、徐放性の薬剤が注射部位に長くとどまり、硬結等の注射部位反応が発現することがあるので、注射部位を毎回変更し、注射部位をもまないように患者に説明するなど十分注意して投与すること。[14.2.2参照]
(参考資料)
- リュープリン注射用PRO注射用キット22.5mg 電子添文
- リュープリン注射用SR注射用キット11.25mg・リュープリン注射用PRO注射用キット22.5mg インタビューフォーム
電子添文の14.1 薬剤調製時の注意には、「用時調整し、懸濁後は直ちに使用すること」と記載があります。懸濁後は直ちにご使用ください1)。
なお、インタビューフォームには懸濁24時間後までの通針性、再分散性、残存率の成績が掲載されています2)。
○リュープリンPRO注射用キット22.5mgの粉末部に液体部の懸濁用液全量(1mL)を加え、懸濁後25℃・60%RHの条件で24時間保存した結果、外観・pH・通針性・再分散性・残存率について特に問題となる変化は認められませんでした。
懸濁が不十分な場合、針詰まり、エア抜き不良などが起こる可能性があります。懸濁後に時間が経過した場合、懸濁が不十分になっている可能性がありますので、再度懸濁してください。
最終的な使用の可否については医療機関で判断してください
注)RH:相対湿度(relative humidity)
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリンPRO注射用キット22.5mgは、患者さんがご自身で注射する、自己注射を想定してデバイスを開発しておりません。
また、自己注射に関するデータもありません。
さらに、硬結などの副作用発現機序、予防方法を鑑み、自己注射としての処方は実施しないようお願いいたします。
リュープリンPRO注射用キット22.5mgを24週間より長いまたは短い間隔で投与した際の保険請求は、地区審査会の判断となるため、地区審査会(国保・社保等)への照会をお願いします。
リュープリンPRO注射用キット22.5mgでは検討した成績がありません。
参考)
リュープリン3.75mg(1ヵ月製剤)を子宮内膜症患者さんに投与した際の排卵回復までの期間をみた成績があります。
子宮内膜症患者さんを対象にリュープリン3.75mgを4週間に1回、24週間投与したところ、排卵回復に要した時間は最終投与日から82.0±16.2日でした1)。
したがって、個人差はありますが、リュープリン3.75mgの最終投与から2~3ヵ月で排卵が回復する可能性があります。リュープリン3.75mgは効果が4週間持続する製剤ですので、効果がなくなってから(最終投与後4週経過時点から)1~2ヵ月で排卵が回復しています。
(参考資料)
- 水野正彦ほか:産婦人科の世界 1992;44(12):923-955.
リュープリン各製剤及び有効成分のリュープロレリン酢酸塩について、血管外漏出時の組織傷害性の分類は設定されていません。
リュープリン各製剤は皮下注製剤であり、血管外漏出時の対応についても検討されていません。
リュープリンPRO注射用キット22.5mgの初回投与から4週間は月経がくる場合があります。
その場合でも、投与4週後以降には月経がなくなる例がほとんどです。
参考)
ホルモン療法未治療の閉経前乳癌患者を対象とした国内第Ⅲ相試験において、リュープリンPRO注射用キット22.5mgを投与したところ、月経が認められた症例は、投与開始4週後時点で83例中50例(60.2%)、投与開始8週後時点で83例中1例(1.2%)でした1)。
(参考資料)
- リュープリンPRO注射用キット22.5mg 申請時概要 2.7.6.3.2.4 p142
(閉経前乳癌:ホルモン療法未治療の閉経前乳癌を対象とした国内第Ⅲ相試験における対照群)
http://www.pmda.go.jp/drugs/2015/P20150925002/index.html(閲覧日:2023年6月30日)
- リュープリンPRO注射用キット22.5mg 申請時概要 2.7.6.3.2.4 p142
<臨床症状>高活性LH-RH誘導体としての下垂体-性腺系刺激作用による性腺ホルモン濃度(エストロゲンもしくはテストステロン)の一過性の上昇に伴い、臨床所見の一過性の悪化が見られることがあります。ホルモン値は概ね投与数日から1-2週間目で一過性に上昇し、投与3-4週頃には去勢レベルに低下します。詳細はインタビューフォーム(薬効を裏づける試験成績)をご確認ください1)。
乳癌:骨疼痛等1)
前立腺癌:前立腺癌の随伴症状(骨性疼痛や排尿困難など)の発現や増悪1)
子宮筋腫、子宮内膜症:血清エストロゲン濃度の一過性の上昇に伴う臨床所見の一過性の悪化1)。
(月経時に見られる疼痛、熱感、ほてり、性器出血をフレアアップの症状と報告されることもありますが、明確には記載されていません。)
対処法:
通常は投与継続中に軽快・消失しますが、症状にあわせて適切な処置を行ってください。なお、前立腺癌の場合、投与初期に抗アンドロゲン剤を短期併用することでフレアアップを予防できるという報告もあります1)。
(乳癌や子宮筋腫、子宮内膜症のフレアアップの対処法について、一定の見解が得られている方法はありません。)
参考
フレアアップ予防の目的で抗アンドロゲン剤を併用する方法2)
非ステロイド性抗アンドロゲン剤はLH-RHアゴニスト投与開始日に併用、ステロイド性抗アンドロゲン剤はLH-RHアゴニストより2週間程度の先行投与が必要です。
<薬剤例>
非ステロイド性抗アンドロゲン剤:フルタミド、ビカルタミド
ステロイド性抗アンドロゲン剤:クロルマジノン酢酸エステル
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
- インフォームドコンセントのための図説シリーズ 前立腺がん、2008、医薬ジャーナル社、p92-93.
リュープリンPRO注射用キット22.5mgの薬価基準収載年月日は、2015年11月26日です1)。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリンPRO注射用キット22.5mgの発売年月日は、2015年12月15日です1)。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリンPRO注射用キット22.5mgの有効期間は、製造日から3年です。(使用期限は、有効期間が満了する日の前月末日です。)
外箱に表示の使用期限内であっても開封後はなるべく速やかに使用してください1)。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
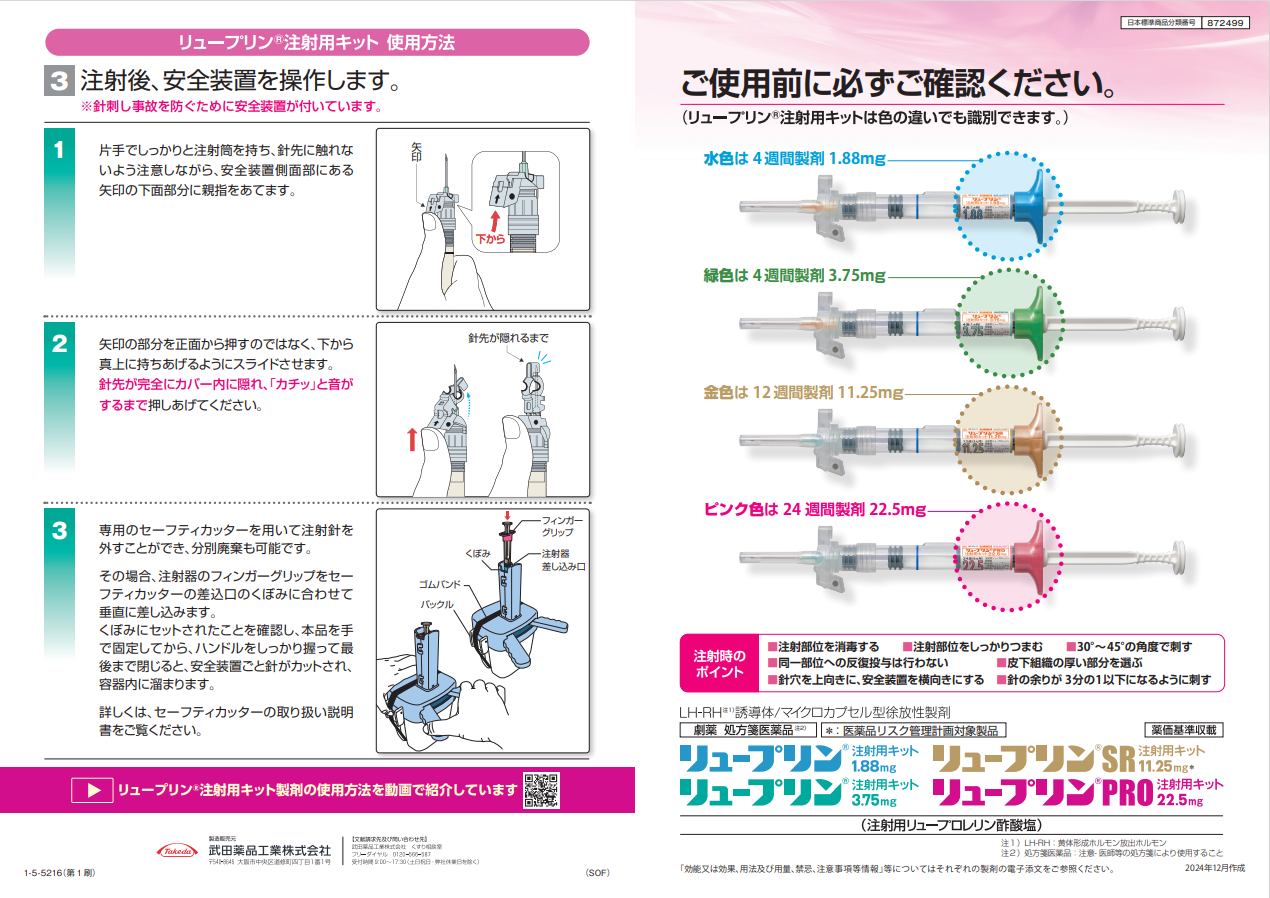
◇リュープリンPRO注射用キット22.5mg1)
『前立腺癌』、『閉経前乳癌』(2015年9月)
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリン各製剤の添付文書には、「併用禁忌」「併用注意」等の、インスリン製剤やワクチン類との同時投与/接種を妨げる記載はありません。1)2)3)
各製剤の添付文書に記載されている注意事項から総合的に判断してください。
(参考資料)
1.リュープリン注射用1.88mg・3.75mg・キット1.88mg・キット3.75mg 電子添文
2.リュープリンSR注射用キット11.25mg 電子添文
3.リュープリンPRO注射用キット22.5mg 電子添文
◇リュープリン1.88mg・3.75mgは、リュープロレリン酢酸塩を含有する乳酸・グリコール酸共重合体を基質としたマイクロカプセルによって、4週間にわたり一定速度でリュープロレリンを放出します1)。
◇リュープリンSR 11.25mgは、乳酸重合体を基剤としたマイクロカプセルを開発したことによって、12週に1回の投与で持続的な有効性を示します2)。
◇リュープリンPRO 22.5mgは、添加物としてステアリン酸と、新たな乳酸重合体を基剤としたマイクロカプセルを開発したことによって、24週に1回の投与で持続的な有効性を示します2)。
(参考資料)
- リュープリン注射用1.88mg・3.75mg・キット1.88mg・キット3.75mg インタビューフォーム
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
キット製剤(1.88mg・3.75mg・SR・PRO)には針がついています。
◇リュープリン注射用キット1.88mg1)
針の太さ:25ゲージ(0.50mm)
◇リュープリン注射用キット3.75mg1)
針の太さ:25ゲージ(0.50mm)
◇リュープリンSR注射用キット11.25mg2)
針の太さ:23ゲージ(0.60mm)
◇リュープリンPRO注射用キット22.5mg2)
針の太さ:23ゲージ(0.60mm)
(参考資料)
- リュープリン注射用1.88mg・3.75mg・キット1.88mg・キット3.75mg 電子添文
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリンPRO注射用キット22.5mgは内袋等がなく箱にそのまま入っていますが、キット製品はその構造により無菌性が担保されています。
箱から出しても針キャップを外すまでは無菌状態です1)。
(参考資料)
- 野々村宗夫ほか(武田薬品):Pharm Tech Japan 1999;15(12):1853-1862.
リュープリンPRO注射用キット22.5mgの貯法は、室温保存です1)。
室温の定義は1-30℃であり、この範囲であれば、冷蔵庫でも保管は可能です。
(参考資料)
- リュープリンPRO注射用キット22.5mg 電子添文
診療報酬に関わることのため、各都道府県の地方厚生局にお問い合わせください。
厚生労働省HPに「診療報酬に関する紹介先」PDFが掲載されております。
お問い合わせ先はそちらをご確認ください。
「診療報酬に関する紹介先(令和2年2月13日現在)」
https://www.mhlw.go.jp/content/12404000/000604242.pdf(閲覧日:2023年6月30日)
令和4年度診療報酬改定で外来化学療法加算には静脈内注射、動脈注射、点滴注射、中心静脈注射、植込型カテーテルによる中心静脈注射などが規定されていますが、リュープリン各製剤の投与経路である「皮下注射」は記載がありません1)。
外来腫瘍化学療法診療料における「抗悪性腫瘍剤」とは、薬効分類上の腫瘍用薬を指すことが示されています2)。
リュープリンの電子添文に記載されている日本標準商品分類番号87 2499は「他に分類されないホルモン剤(抗ホルモン剤を含む)」です。腫瘍用薬には分類されていません。
保険診療における取り扱いにつきましては、審査機関へご確認をお願いいたします。
(参考資料)
- 令和4年度診療報酬改定 第3 関係法令等【省令・告示】
(2)1診療報酬の算定方法の一部を改正する件
厚生労働省告示第54号 別表第1(医科点数表)<第2章>第6部 注射、通則6
https://www.mhlw.go.jp/content/12404000/000907834.pdf - 令和4年度診療報酬改定 第3 関係法令等 【事務連絡】
疑義解釈資料の送付について(その14)厚生労働省保険局医療課 事務連絡 令和4年6月22日別添 問3
https://www.mhlw.go.jp/content/12404000/000954941.pdf
- 令和4年度診療報酬改定 第3 関係法令等【省令・告示】
リュープリンPRO注射用キット22.5mgは、腎臓をはじめ各組織で加水分解により代謝されますが、血漿中では代謝されません1)。
参考)
リュープロレリン酢酸塩のヒトにおける代謝経路については検討成績がありません。
ラット、イヌの体内における検討では、加水分解によりD-Leu残基を含むM-Ⅰとアミノ末端の5-oxo-Proを含むM-Ⅲに変換された後、M-ⅠはM-Ⅱに、M-ⅢはM-Ⅳにさらに代謝され、一部は最終的にCO2にまで代謝されると考えられます1)。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリンPRO注射用キット22.5mgの排泄部位、排泄経路は、尿中、糞中、呼気中です。(参考[ラット、イヌ])1)
参考)
[14C-D-Lew]※リュープロレリン酢酸塩水溶液をラット、イヌに皮下投与したとき、投与72時間までに投与した14Cは、ラットで尿中に48.8%、糞中に21.6%、呼気中に16.1%排泄されました。また、イヌではそれぞれ68.2%、16.8%、11.6%排泄されました1)。
※ 14Cで標識したもの D:アスパラギン酸の一文字表記
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
高活性LH-RH誘導体であるリュープロレリン酢酸塩を反復投与すると、初回投与直後一過性に下垂体ー性腺系刺激作用(急性作用)がみられた後、下垂体においては性腺刺激ホルモンの産生・放出が低下します。更に、精巣及び卵巣の性腺刺激ホルモンに対する反応性が低下(desensitization)し、テストステロン及びエストラジオール産生能が低下します(慢性作用)1)。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
リュープリン注射用4週(1ヵ月)3.75mg、12週(3ヵ月)SR11.25mg、24週(6ヵ月)PRO22.5mgの適応症例に合わせて、ご使用ください。
リュープリン注射用1.88mg、3.75mg製剤は、当初はバイアル品のみでしたが、利便性向上のためにキット品を発売いたしました。なお、用量調整が必要な場合キット品はご使用いただけません。
国内臨床試験では未治療例の前立腺癌、ホルモン療法未治療の閉経前乳癌術後例を対象にリュープリンSR11.25mg、リュープリンPRO22.5mgをそれぞれ投与開始した試験もございます1)。
最初からリュープリン注射用12週(3ヵ月)SR11.25mg製剤、24週(6ヵ月)PRO22.5mg製剤から開始、もしくはリュープリン注射用4週(1ヵ月)3.75mg製剤から開始してリュープリン注射用12週(3ヵ月)SR11.25mg製剤、24週(6ヵ月)PRO22.5mg製剤に切り替えることも可能です。
患者様やご施設の状況にあわせてご判断ください。
(参考資料)
- リュープリンSR注射用キット11.25mg・リュープリンPRO注射用キット22.5mg インタビューフォーム
用法・用量は剤形別に決まっています1)2)3)。
前回投与した製剤の次回の投与時期に切り替えていただくことが望ましいと考えられます。
例)リュープリンSR 11.25mg(12週製剤)からリュープリンPRO 22.5mg(24週製剤)への切り替えの場合
リュープリンSR 11.25mg投与から12週後にリュープリンPRO 22.5mgを投与開始します。
(参考資料)
- リュープリン注射用1.88mg・3.75mg・キット1.88mg・キット3.75mg 電子添文
- リュープリンSR注射用キット11.25mg 電子添文
- リュープリンPRO注射用キット22.5mg 電子添文
特に設定されていません1)2)3)。
(参考資料)
- リュープリン注射用1.88mg・3.75mg・キット1.88mg・キット3.75mg 電子添文
- リュープリンSR注射用キット11.25mg 電子添文
- リュープリンPRO注射用キット22.5mg 電子添文