基本情報
|
2024年11月22日 |
|
| ニンラーロカプセル0.5mg新発売のご案内 | |
|
2024年11月20日 |
|
| ニンラーロカプセル0.5mg薬価基準収載のご案内 | |
|
2024年08月19日 |
|
| ニンラーロカプセル0.5mg製造販売承認(剤形追加)取得のご案内 |
製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
多発性骨髄腫全国Web講演会
多発性骨髄腫全国Web講演会
Hematology全国Web講演会
医薬品リスク管理計画書
適正使用ガイド





















疾患情報資材
本剤は、妊娠又は妊娠している可能性のある女性には禁忌です。
ウサギにおいて、AUC比較で臨床曝露量の1.8倍に相当する用量で催奇形性(胎児の尾椎異常及び短尾)が認められました。
ニンラーロ 電子添文
授乳婦へのニンラーロカプセルの投与は治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。ニンラーロカプセルのヒト乳汁中への移行は不明です1)。
ニンラーロ 電子添文
必要期間処方可能です。ただしニンラーロカプセルの長期処方の際には過量投与にご注意ください。
<多発性骨髄腫における維持療法を受ける患者さんの場合>
ニンラーロカプセルを24ヵ月(約26サイクル)を超えて投与した場合の有効性及び安全性は確立していません。
なお、ニンラーロカプセルを長期処方する際の保険請求については請求先の審査機関へお問い合わせください。
ニンラーロ 電子添文
ニンラーロカプセル単剤による「多発性骨髄腫の維持療法」を受ける患者さんの状態によっては、医師の判断で5サイクル以降もニンラーロカプセル3mgでの継続投与が可能です。その場合、5サイクル以降であれば後々4mgに増量することは可能です。
国際共同第Ⅲ相臨床試験(C16019試験及びC16021試験)においては、臨床的効果を考え、ニンラーロカプセルの投与量は4サイクルまでは3mg、5サイクル以降は4mgとプロトコルで事前設定されました1, 2)。
(参考資料)
- Dimopoulos MA, et al.: Lancet. 2019; 393: 253-264.
- Dimopoulos MA, et al.: J Clin Oncol. 2020; 38(34): 4030-4041.
ニンラーロカプセル 電子添文1)では、「多発性骨髄腫における維持療法」の5サイクル以降での増量について、具体的な基準や患者さんの状態についての記載はありません。
(参考)
ニンラーロカプセル 適正使用ガイド2)では、国際共同第Ⅲ相試験(C16019試験、C16021試験)において、ニンラーロカプセルの用量を3mgから4mgへと増量する際の適格患者さんについて、以下のように記載されてます。
別添5. 国際共同第Ⅲ相試験(C16019試験)の概要(抜粋)
* 最初の4サイクルを施行後、適格な患者※に対する本剤(又はプラセボ)の用量を3mgから4mgへと増量する。
※増量は、直前の2サイクル(サイクル3及び4)実施中に、治験薬に関連するGrade 2以上の非血液性有害事象がなく、治験薬の毒性に関連する投与中断がなく、治験薬の毒性に起因する1週間を超えるサイクル開始の遅延がないことを条件とする。
何らかの用量減量があった患者はその後に増量しない。
1. ニンラーロ 電子添文
2. ニンラーロ 適正使用ガイド
ニンラーロカプセル 電子添文1)では、「多発性骨髄腫における維持療法」の5サイクル以降に増量し、減量を行った後に再度増量する場合についての規定は記載されてません。
しかし、国際共同第Ⅲ相試験(C16019試験、C16021試験)において、ニンラーロカプセルの毒性発現により減量が必要となった患者さんには、再増量を許可しないこととなっていました1), 2)。
1. Dimopoulos MA, et al.: Lancet. 2019; 393: 253-264.
2. Dimopoulos MA, et al.: J Clin Oncol. 2020; 38(34): 4030-4041.
ニンラーロカプセルの増量を判断する際に、患者さんの状態確認が必要となります。患者さんの忍容性を確認するため、4サイクルまでは3mgでの投与をお願いいたします。
なお初回から4mg、あるいは1~4サイクルの間で増量したデータはありません。
ニンラーロカプセル電子添文の記述のとおり、5サイクル以降での増量をお願いします。
(参考)
<増量のタイミングが5サイクル目の理由>
ニンラーロカプセルの増量のタイミングは、患者さんがニンラーロカプセルの治療に耐えうるか早期に決定できるという考えに基づいています。
5つの第Ⅰ/Ⅱ相試験(データカットオフ2013年2月15日)の参加者275例において、31例(11.6%)の患者さんが有害事象によってニンラーロカプセルの投与を中止しました。この31例の患者さんのうち、27例(87%)の患者さんはサイクル4の終了時までに投与を中止しました1, 2)。
1. Dimopoulos MA, et al.: Lancet. 2019; 393: 253-264.
2. Dimopoulos MA, et al.: J Clin Oncol. 2020; 38(34): 4030-4041.
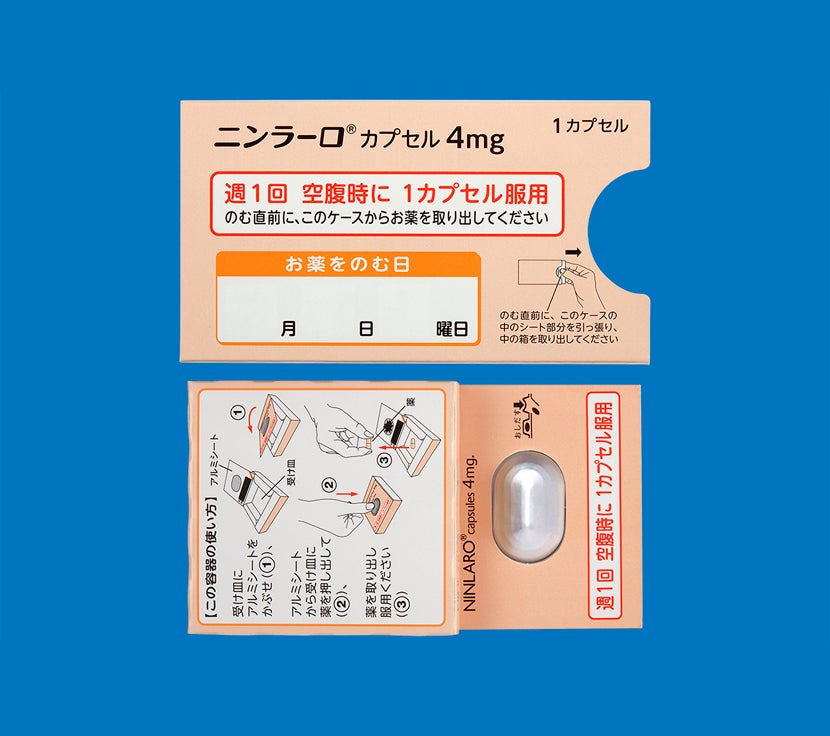
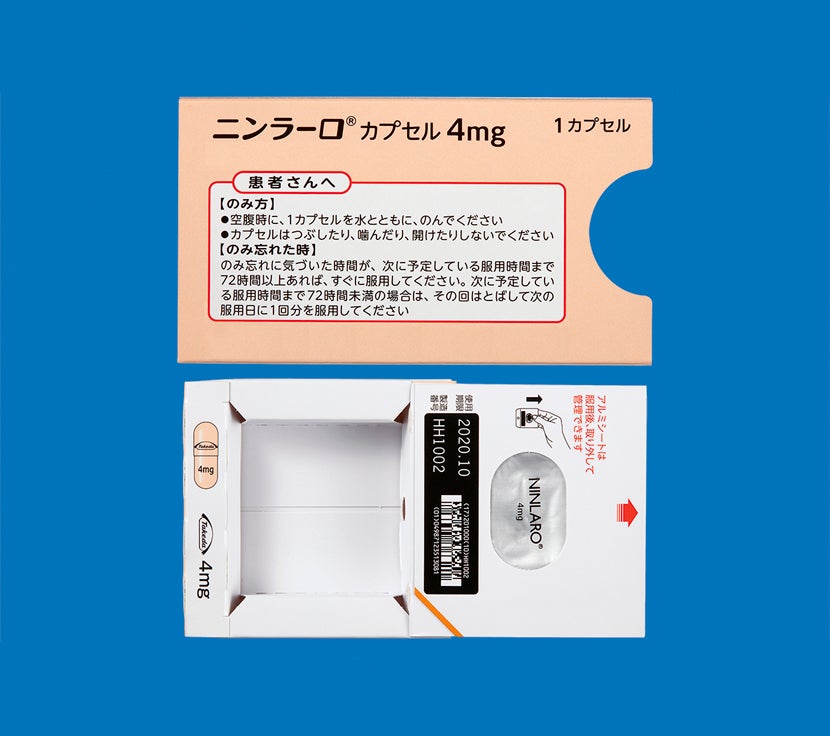
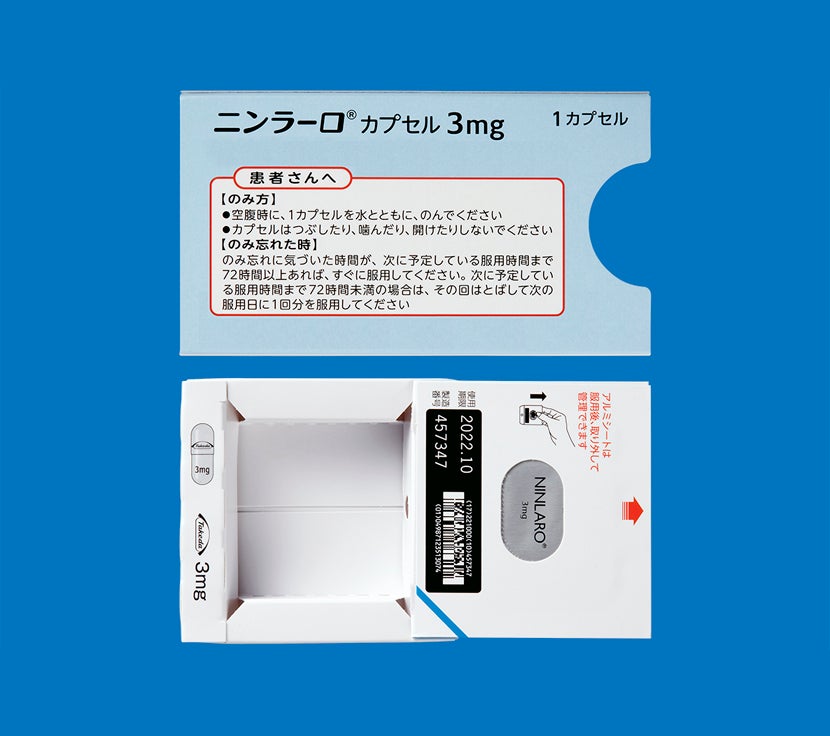
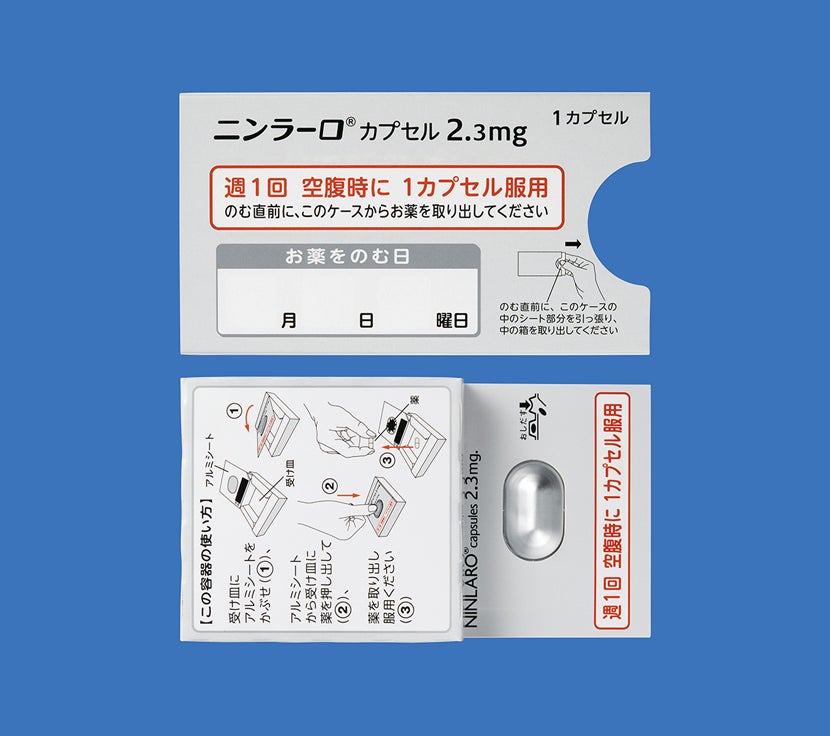
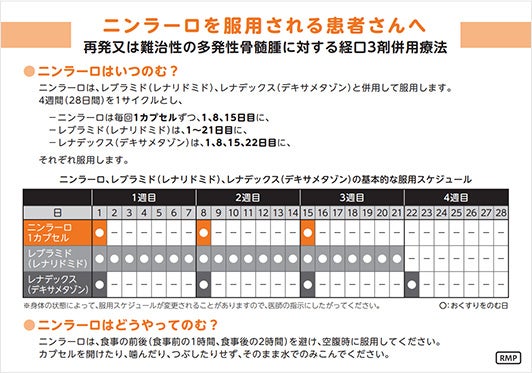
「再発又は難治性の多発性骨髄腫」患者さん及び「多発性骨髄腫における維持療法」を受ける患者さんにおけるニンラーロカプセルの用法は、空腹時投与です。
食後にニンラーロカプセルを服用した場合、本剤のCmaxおよびAUCが低下するとの報告があります。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けてください1)。
参考)
高脂肪食以外と検討した成績はございません。
【外国人データの食事の内容】2)
高脂肪食の内容は、高カロリー(850kcal以内)、高脂肪(脂肪は総カロリーの60%以内)で、おおよそ次のような食事です。
・2つの目玉焼きあるいはスクランブルエッグ
・2切れのベーコン
・トースト(と小さじ1杯のバター)2枚
・60-120gのフライドポテト
・240-280mLの牛乳(全乳)
1. ニンラーロ 電子添文
2. Gupta N, et al.: Clin Pharmacol. 2016; 56(10): 1288-1295.
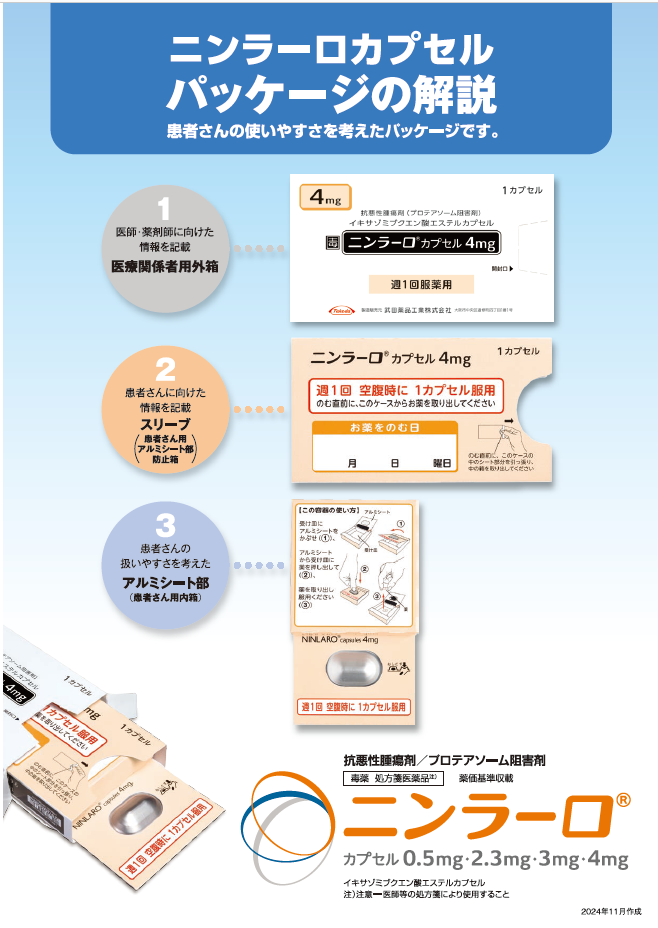
ニンラーロカプセルの調剤時には脱カプセル及び粉砕投与をしないようにお願いします。
1. ニンラーロ 電子添文
該当データはございません。1)
カプセルはつぶしたり、噛んだり、開けたりせず、そのまま水とともに服用するようにご指導ください。2)
1. ニンラーロ インタビューフォーム
2. ニンラーロ 電子添文
下痢の症状評価のCTCAE v4.0-JCOGに従って重症度ごとで対応します。
症状によって止瀉薬としてロペラミド等で対処します。詳細は、副作用アーカイブ:胃腸障害をご参照いただければ幸いです。
1. 副作用アーカイブ:胃腸障害 P.5-6
ニンラーロカプセルの電子添文には嘔吐に対する前投薬(プレメディケーション)に関する記載はありません。
催吐性リスク分類をもとにご施設でご判断ください。
<催吐性リスク分類について>1)
ニンラーロは日本癌治療学会の制吐薬適正使用ガイドライン2015年10月【第2版】ver.2.2で催吐頻度10~30%の軽度(催吐性)リスクに分類されています。
<臨床試験時の制吐剤の使用状況>2), 3)
国際共同第Ⅲ相試験(C16019試験:TOURMALINE-MM3)、国際共同第Ⅲ相試験(C16021試験:TOURMALINE-MM4)においては、悪心・嘔吐に対しては5-HT3受容体拮抗薬の使用が推奨され、その後の予防投与も考慮されることになっていました。なお制吐剤としてのデキサメタゾンの使用は禁止されておりました。
1. 日本癌治療学会「制吐薬適正使用ガイドライン」2023年10月改訂 第3版(http://www.jsco-cpg.jp/antiemetic-therapy/ 閲覧日:2024年8月16日)
2. Dimopoulos MA, et al.: J Clin Oncol. 2020; 38(34): 4030-4041.
3. Dimopoulos MA, et al.: J Clin Oncol. 2020; 38(34): 4030-4041.
感染症は電子添文の11.1.6に重大な副作用に挙げられています1)。
患者さんの安全性の確保の観点から帯状疱疹に対する予防投与を推奨します2)。
なお、帯状疱疹に対する抗ウイルス薬(バラシクロビル、アシクロビル、ファムシクロビル)の予防投与は国内で承認された効能・効果ではありませんが、社会保険診療報酬支払基金では、アシクロビルについては原則として、本剤使用時の帯状疱疹の発症抑制に対して処方した場合、「当該使用事例を審査上認める」とされています3)。
1. ニンラーロ 電子添文
2. ニンラーロ 適正使用ガイド
3.https://www.ssk.or.jp/shinryohoshu/sinsa_jirei/teikyojirei/yakuzai/no600/jirei326.html(閲覧日:2024年8月9日)
ニンラーロカプセルの有効期間は、製造日から3年です1)。
使用期限内であっても開封後はなるべく速やかに使用してください。
(使用期限は、有効期間が満了する日の前月末日です。)
1. ニンラーロ インタビューフォーム
電子添文14.2.1 では、「吸湿を防ぐためPTP包装のまま保存し、服用時にPTPシートから取り出すように指導すること。」と注意喚起しており、シートから出しての保管はお勧めしておりません。1)
なお、一包化を検討した成績はございません。また、長期保存試験はブリスター包装のみで検討されており、非包装の情報は光安定性試験のみですが、光安定性試験では期間の設定はありません。2)
1. ニンラーロ 電子添文
2. ニンラーロ インタビューフォーム
臨床用量における血漿中濃度付近のニンラーロカプセルの代謝には主にCYP以外の蛋白が関与し、特定のCYP分子種が関与しないことが示唆されています。1)
また、代謝経路は特定されていません。
1. ニンラーロ 電子添文
ニンラーロカプセルは主に尿及び糞中に排泄されます。
16.5 排泄1)
本剤の放射性標識体を進行がん患者5例に単回経口投与した時、投与後34日までに投与した放射能の62%が尿中に、22%が糞中に排泄された。また、投与後7日までに尿中に回収された未変化体は投与量の3.2%であった(外国人データ)。
1. ニンラーロ 電子添文
ニンラーロカプセルの電子添文1)では、「イキサゾミブは20Sプロテアソームのβ5サブユニットに結合し、キモトリプシン様活性を阻害することにより、腫瘍細胞のアポトーシスを誘導し、腫瘍増殖を抑制すると考えられている。」と記載されています。
1. ニンラーロ 電子添文
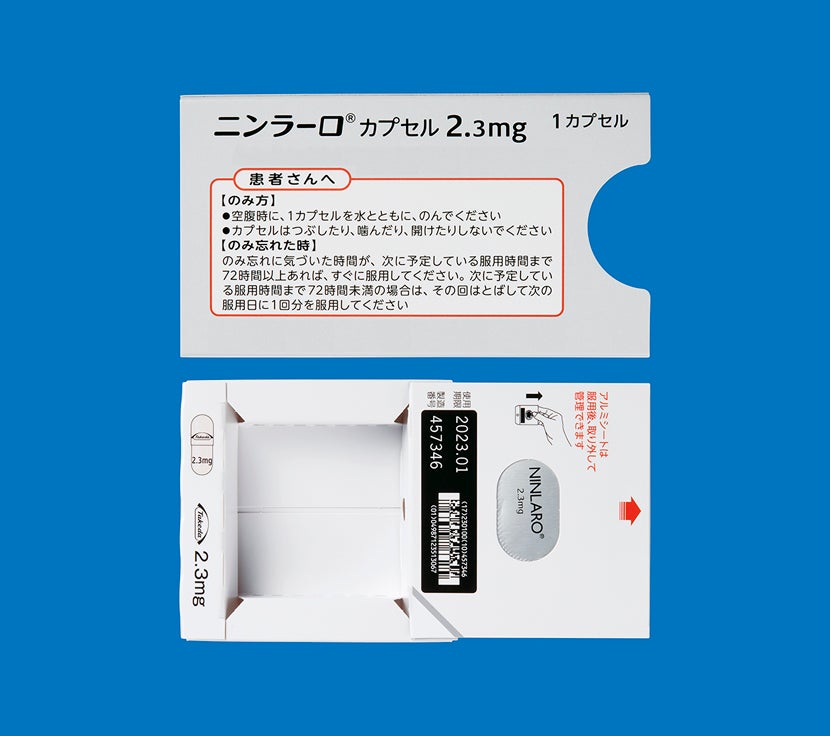
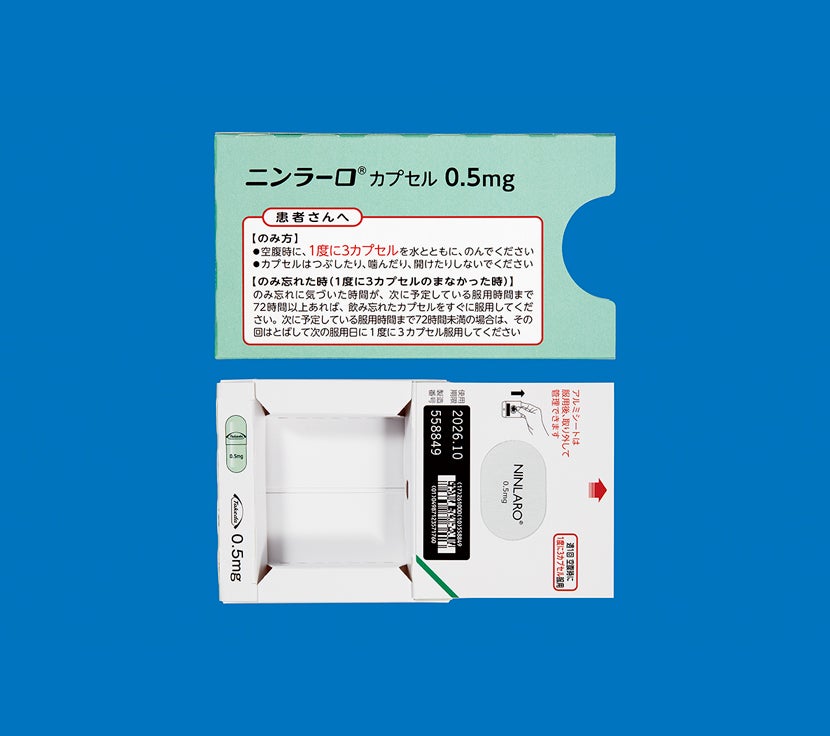
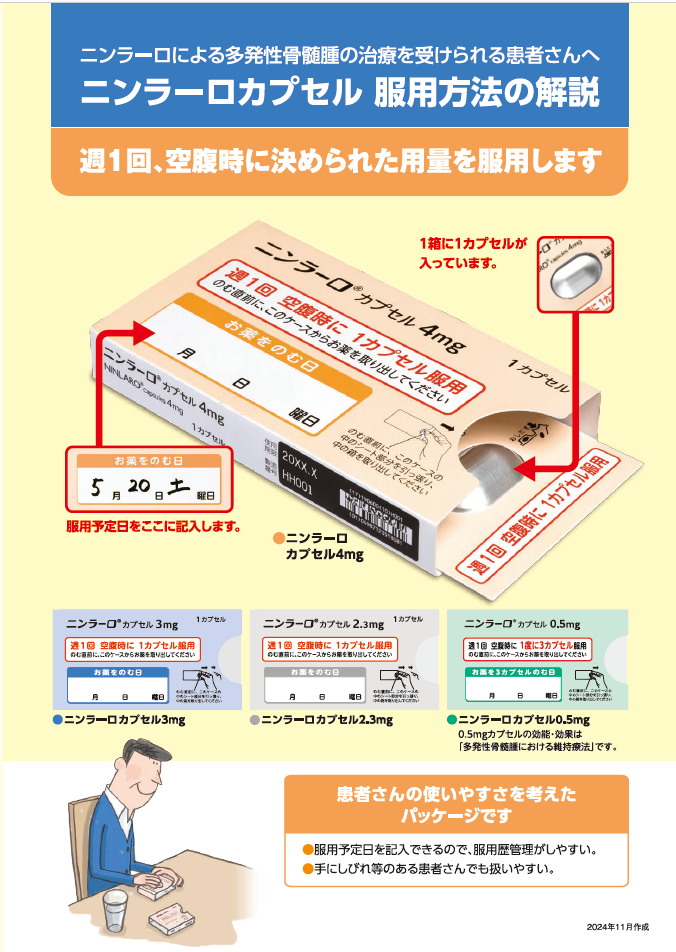
次に服用を予定している時間まで72時間以上ある場合気づいたときにすぐ服用してください。
次に服用を予定している時間まで72時間未満の場合飲み忘れた分は服用せず、次に予定している服用から再開してください。
1. ニンラーロ 適正使用ガイド
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。