基本情報
|
2024年08月28日 |
|
| リブテンシティ錠200mg新発売のご案内 | |
|
2024年08月16日 |
|
| リブテンシティ錠200mg薬価基準収載のご案内 | |
|
2024年06月25日 |
|
| リブテンシティ錠200mg製造販売承認取得のご案内 |
製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
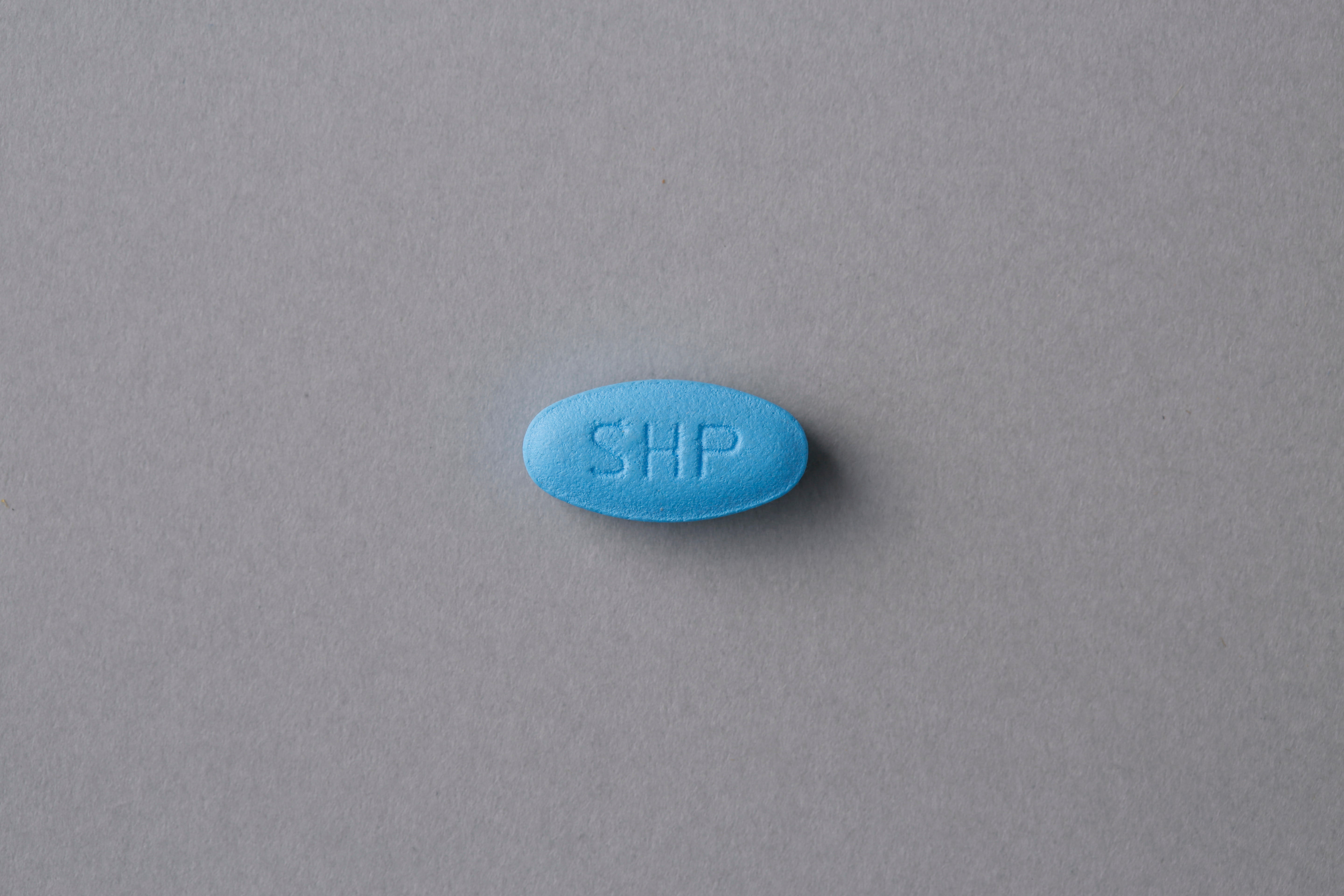
抗サイトメガロウィルス化学療法剤です。
リブテンシティ錠 電子添文
ボトル包装(28 錠、バラ)です。
リブテンシティ錠 電子添文
「臓器移植(造血幹細胞移植も含む)における既存の抗サイトメガロウィルス療法に難治性のサイトメガロウイルス感染症」です。
リブテンシティ錠 電子添文
「通常、成人にはマリバビルとして1 回400 mg を1 日2 回経口投与する。」です。
リブテンシティ錠 電子添文
室温保存です。
リブテンシティ錠 電子添文
3年です。
リブテンシティ錠 電子添文
キャップをボトル本体に強く押しつけたまま(カチカチ音がしない状態まで)左に回して開けてください。
リブテンシティ錠 電子添文
ラットに[14C]標識マリバビルを経口投与したき、マリバビルは全身に広く分布しましたが、マリバビルの血液脳関門の透過性は低く、通過量は定量不能でした。
リブテンシティ錠 インタビューフォーム
健康成人(30例)を対象に、マリバビル400mgを単回経口投与したとき、空腹時投与に対する高脂肪/高カロリー食後投与のCmax、AUC∞及びAUClastの最小二乗幾何平均値の比はそれぞれ0.716%、0.878及び0.874でした。また、絶食下投与に対する低脂肪/低カロリー食後投与のCmax、AUC∞及びAUClastの最小二乗幾何平均値の比はそれぞれ0.766、0.847及び0.841でした。(外国人データ)
リブテンシティ錠 電子添文
薬物動態試験によって異なり、それぞれ5.48時間1)、3.79時間でした2)。
1)リブテンシティ錠 インタビューフォーム マリバビル単独投与時及びケトコナゾールと併用投与時のマリバビル及び VP44469の薬物動態パラメータ(外国人データ)
2)リブテンシティ錠 インタビューフォーム マリバビル単独投与時及びリファンピシンと併用投与時のマリバビル及び VP44469の薬物動態パラメータ(外国人データ)
流通制限は、ありません。
本剤に対する耐性を示すウイルス由来のプロテインキナーゼ(UL97)変異がガンシクロビル及びバルガンシクロビルに対する交差耐性をもたらす可能性があります。
マリバビル及びガンシクロビルのEC50 は、F342Y によりそれぞれ4.5 及び6.0 倍増加し、C480F によりそれぞれ224 倍及び2.3 倍増加しました(in vitro)。
リブテンシティ錠 電子添文
・強いCYP3A4 誘導薬:カルバマゼピン、フェノバルビタール、フェニトイン、リファブチン、リファンピシン、 セイヨウオトギリソウ※ (※セイヨウオトギリソウによる作用は濃度、用量及び製品に左右される)
・中程度のCYP3A4 誘導薬:ボセンタン、エファビレンツ、エトラビリン、モダフィニル が挙げられます。
医薬品開発と適正な情報提供のための薬物相互作用ガイドライン, 厚生労働省https://www.mhlw.go.jp/web/t_doc?dataId=00tc0233&dataType=1&pageNo=3(2025年3月アクセス)
マリバビルの第Ⅱ相試験において、申請用法及び用量(本薬400mg BID)の3倍量(本薬1,200mg BID)までの安全性が確認され、安全性プロファイルは許容可能とされました。強い又は中程度のCYP3A4誘導剤(フェニトイン、フェノバルビタール、カルバマゼピン、エファビレンツ、リファブチン等)のCYP3A4誘導能は、リファンピシンほど強くはないことから、これらのCYP3A4誘導剤との併用下において本薬1,200 mg BIDまで増量した場合には、非併用下での400 mg BID投与時の血漿中本薬Ctroughと概ね同程度以上の曝露量が得られる可能性があることから、1,200mgまでの増量を考慮することが可能と判断されました。
リブテンシティ錠 審査報告書
電子添文に記載はありません。
本薬とCYP3A4及びP-gpの阻害薬であるケトコナゾール経口剤との併用に係る臨床薬物相互作用試験の結果、本薬のAUCinfは、非併用時と比較して1.53倍上昇することが確認されていますが、リブテンシティの第Ⅱ相試験において、申請用法及び用量(本薬400mg BID)の3倍量(本薬1,200mg BID)までの安全性が確認され、安全性プロファイルは許容可能であったことを踏まえ、CYP3A4阻害薬との併用について、注意喚起を設定する必要性は低いと判断されました。
リブテンシティ錠200mg審査報告書
海外第Ⅲ相検証試験において、マリバビルに対する耐性を付与するUL97遺伝子変異が234例中60例(25.6%)に認められました。そのうち18例では試験期間を通してCMV血症消失が認められず、試験期間中にCMV血症消失が認められた42例中39例ではCMV血症が再発しました。
リブテンシティ錠 電子添文
海外第Ⅲ相検証試験のIAT群で3週間以上の投与を受けた後に、以下の基準のいずれか満たした患者さんは、レスキュー群への移行が認められました。
①定量PCRで測定した全血又は血漿中CMV血症レベルがベースライン時より1 log10以上増加したこと。
②組織侵襲性CMV感染症を有し、以下の両方の基準を満たしていること。
・定量PCRで測定した全血又は血漿中CMV DNA量の減少がベースライン時より1 log10未満であること。
・ベースライン時に組織侵襲性CMV感染症を有していた場合には、治験責任医師により改善していない又は悪化したと評価されたこと。ベースライン時に組織侵襲性CMV感染症を有していなかった場合には、新規に発症したこと。
③CMV血症消失が達成できておらず、抗CMV薬による治療継続が必要でありながら、IATに対して以下のいずれかの不耐容を示していること。
・ホスカルネット又はcidofovirの投与により血清クレアチニンの急性上昇(ベースライン値から少なくとも50%の増加)を認めたこと。
・ホスカルネット又はcidofovirの投与により、出血性膀胱炎を発症したこと。
・ガンシクロビルまたはバルガンシクロビルの投与により、好中球減少症(好中球絶対数<500/mm3)を発症したこと。
Avery RK, et al. Clin Infect Dis. 2022; 75(4): 690-701. 本試験は武田薬品工業株式会社の資金提供により実施された。
・タクロリムス(リブテンシティ群:178例/234例、IAT群:79例/116例)
・ミコフェノール酸(リブテンシティ群:178例/234例、IAT群:46例/116例)
・シクロスポリン(リブテンシティ群:104例/234例、IAT群:23例/116例)
・エベロリムス(リブテンシティ群:13例/234例、IAT群:8例/116例)
・シロリムス(リブテンシティ群:13例/234例、IAT群:8例/116例)
・アザチオプリン(リブテンシティ群:9例/234例、IAT群:4例/116例)
・ベラタセプト(本邦未承認薬)(リブテンシティ群:3例/234例、IAT群:1例/116例)
でした。
Avery RK, et al. Clin Infect Dis. 2022; 75(4): 690-701. 本試験は武田薬品工業株式会社の資金提供により実施された。
主要評価項目につき、ベースライン時の症候性CMV感染の有無別に検討することは解析計画にあり、ベースライン時に症候性CMV感染を有していた患者さんにおいては、リブテンシティ群では10例/21例(47.6%)が主要評価項目を達成し、IAT群では1例/8例(12.5%)が主要評価項目を達成しました。
また、ベースライン時に症候性CMV感染を有していない患者さんにおいては、リブテンシティ群では121例/214例(56.5%)が主要評価項目を達成し、IAT群では27例/109例(24.8%)が主要評価項目を達成しました。
Avery RK, et al. Clin Infect Dis. 2022; 75(4): 690-701. 本試験は武田薬品工業株式会社の資金提供により実施された。
各ボタンはくすりの適正使用協議会サイトにリンクします。
- 「くすりのしおり」は、くすりの適正使用協議会が定めた基本フォーマットにしたがって作成しております。 詳しくは、「くすりのしおり」トップページをご参照ください。
- 「くすりのしおり」は作成時点の電子添文に基づいておりますが、電子添文に記載された全ての情報を網羅してはおりません。服薬指導資料を作成される際には、最新の電子添文などをご確認いただき、その患者さんにとって必要な注意事項や、医療機関の実情に合わせて加筆修正のうえ、ご利用くださいますようにお願い申し上げます。
- 「くすりのしおり」のご利用によって、直接または間接的に損害が生じても、弊社はいかなる責任も負いません。