基本情報
|
2024年05月30日 |
|
| アジンマ静注用1500 新発売のご案内 | |
|
2024年05月22日 |
|
| アジンマ静注用1500 薬価基準収載のご案内 | |
|
2024年03月27日 |
|
| アジンマ静注用1500 製造販売承認取得のご案内 |
製品・疾患紹介動画
製品に関するWeb講演会
製品に関するWeb講演会
アジンマ適正使用ガイド
12歳未満の小児等を対象とした臨床試験は実施しておらず、有効性および安全性は確立しておりません。
(参考資料)
・アジンマ静注用1500 電子添文
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与することとされています。
ラットを用いた雌受胎能及び胚・胎児発生に関する試験では、母動物に毒性所見は認められず、受胎能にも関連した影響は認められませんでした。一方で、臨床試験において妊婦に対する本剤の安全性は確立されておらず、妊娠、胎児又は出生児への影響が不明であり、妊婦に本剤を投与するか否かは、治療上のリスク/ベネフィットを考慮して判断する必要があることから設定しています。
(参考資料)
・アジンマ静注用1500 電子添文
・アジンマ静注用1500 インタビューフォーム
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討することとされています。
動物における乳汁移行試験を実施していないこと、ヒトでの哺乳中の児における影響が不明であることから、授乳におけるリスクを考慮して設定しています。
(参考資料)
・アジンマ静注用1500 電子添文
・アジンマ静注用1500 インタビューフォーム
本剤を添付の溶解液5mLで溶解し、2~4mL/分の速度で緩徐に静脈内に注射します。
定期的に投与する場合、通常、成人及び12歳以上の小児には、1回40国際単位/kgを隔週投与しますが、患者さんの状態に応じて1回40国際単位/kgを週1回投与することができます。
急性増悪時に投与する場合、通常、成人及び12歳以上の小児には、1日目に1回40国際単位/kg、2日目に1回20国際単位/kg、3日目以降は1日1回15国際単位/kgを投与します。
(参考資料)
・アジンマ静注用1500 電子添文
先天性血栓性血小板減少性紫斑病です。
(参考資料)
・アジンマ静注用1500 電子添文
他の製剤と混合しないでください。
(参考資料)
・アジンマ静注用1500 電子添文
・アジンマ静注用1500 インタビューフォーム
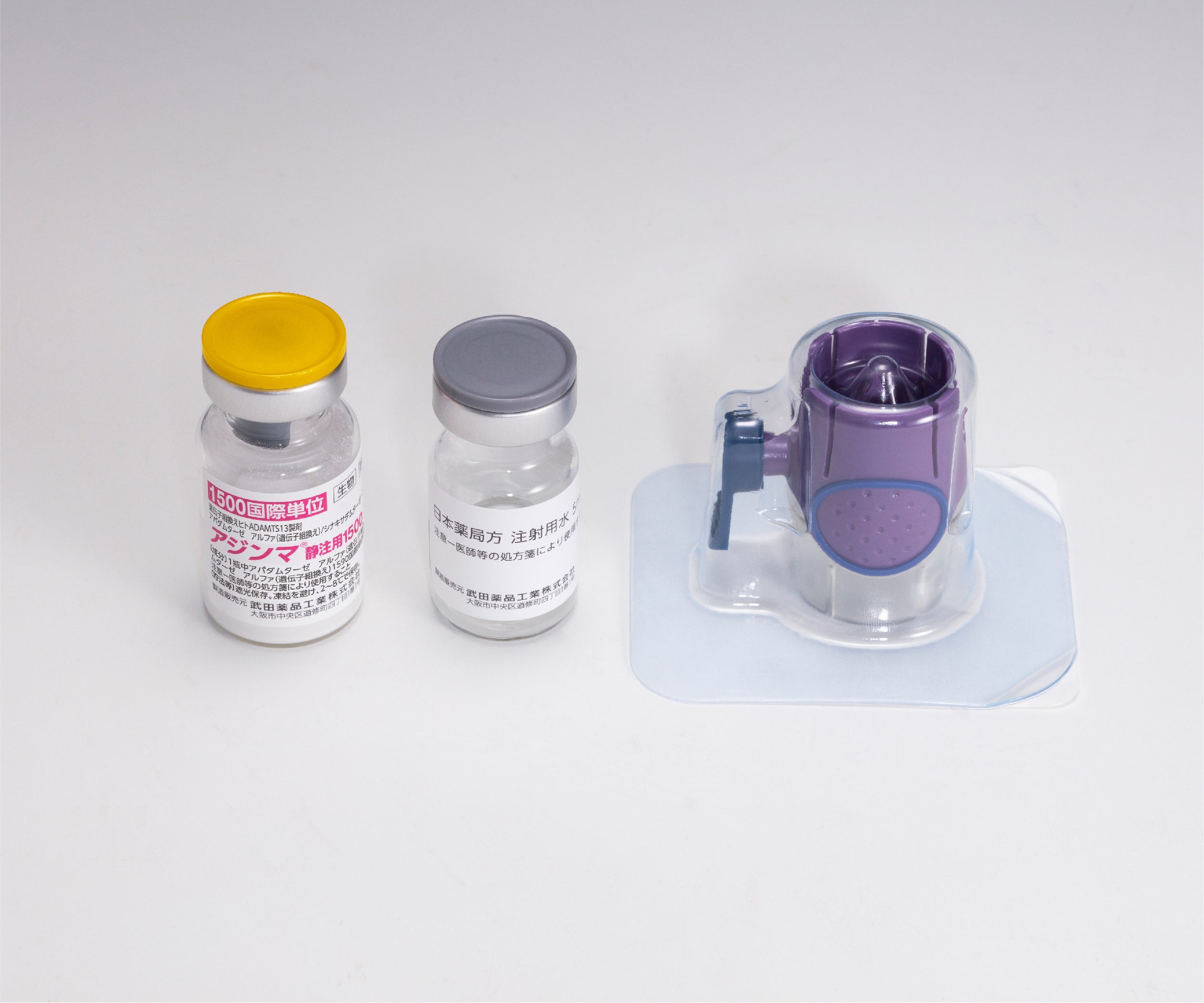
本剤の1回の投与につき複数バイアルを要する場合には、バイアルごとに新たな添付の専用溶解器(薬液用両刃針)を使用して溶解してください。使用済みの専用溶解器(薬液用両刃針)は再使用せずに廃棄してください。
(参考資料)
・アジンマ静注用1500 電子添文
1回の投与量として薬液のバイアルが2本以上必要な場合は、それぞれのバイアルの薬液を同じ注射用シリンジに移行することができます。
ただし、それぞれの溶解操作はバイアルごとに新たな専用溶解器を使用してください。
(参考情報)
・アジンマ静注用1500 適正使用ガイド
溶解後の薬液は、無色澄明になります。
溶解時に沈殿や変色が認めれられた場合、使用しないでください。
(参考資料)
・アジンマ静注用1500 電子添文
薬液の調製後は3時間以内に使用してください。また、溶解後3時間以内に使用しなかった場合は廃棄してください。
(参考資料)
・アジンマ静注用1500 電子添文
凍結を避け、2~8℃で保存してください。
やむを得ず冷蔵保存できない場合には、凍結を避け、室温で使用期限を超えない範囲で最長6ヵ月間保存することができますが、再び冷蔵庫に戻さないでください。
また、直射日光を避けるため、外箱に入れて保存してください。
(参考資料)
・アジンマ静注用1500 電子添文
生物由来製品、処方箋医薬品です。
(参考資料)
・アジンマ静注用1500 電子添文
アジンマ静注用1500の重大な副作用は、ショック、アナフィラキシー(頻度不明)です。
なお、重度のcTTP(先天性血栓性血小板減少性紫斑病)患者さんを対象とした第Ⅲ相臨床試験*ではショック、アナフィラキシーに関する副作用は認められませんでしたが、本剤の成分(特に本剤の製造に用いられているCHO細胞のタンパク質)に対して過敏症の既往歴のある患者さんに本剤を投与した場合、ショック、アナフィラキシーの発現につながるおそれがあるため、設定しました。
その他の副作用として、悪心、熱感が2~5%未満で認められています。
また、血小板増加症、便秘、腹部膨満、頭痛、傾眠、そう痒症、高血圧、ADAMTS13活性異常が2%未満で認められました。
*281102試験及びその継続試験であるTAK-755-3002試験
(参考資料)
・アジンマ静注用1500 電子添文
・アジンマ静注用1500 インタビューフォーム
重度のcTTP(先天性血栓性血小板減少性紫斑病)患者さんを対象とした国際共同第Ⅲ相臨床試験*において、本剤を投与した患者さんにインヒビターの発生は認められませんでした。
なお、本剤が投与されたcTTP患者さん54名中6名にて、ADAMTS13に対する低力価の結合抗体が認められましたが、有効性及び安全性への臨床的な影響はなく、抗体価の経時的増加も認められませんでした。
しかし、本剤は遺伝子組換えタンパク質製剤であり、本剤に対するインヒビターの発生により本剤の有効性の欠如に至る可能性があることから、RMP(医薬品リスク管理計画書)の【重要な潜在的リスク】に設定しています。
*281102試験及びその継続試験であるTAK-755-3002試験
(参考資料)
・アジンマ静注用1500 電子添文
在宅自己注射指導管理料の加算対象となっておらず、在宅自己注射は認められていません。
自己注射が可能となる時期は未定です。