リアルワールドエビデンス(RWE)とは


リアルワールドエビデンス(RWE)とは
無作為化比較試験(RCT)は、医薬品評価のゴールドスタンダードであり、新しい治療法の有効性(Efficacy)及び安全性を評価します。
しかし、RCTには厳格な選択基準及び除外基準があるため、日々の診療で治療する患者集団は、RCTの被験者である患者集団とは多少異なる可能性があります。 そのため、リアルワールドエビデンス(RWE)は、より幅広い患者集団における新しい治療法の有効性(Efficacy)及び安全性について、更なる重要な情報を得るのに役立ちます。
このセクションでは、リアルワールドエビデンスとは何であり、なぜ臨床の意思決定においてリアルワールドエビデンスを検討することが重要であるのかについての背景を説明します。
リアルワールドデータ(RWD)及びリアルワールドエビデンスの概要については、以下の「なぜリアルワールドエビデンスが重要なのか」をクリックし、「リアルワールドエビデンスとは何か、なぜ臨床の意思決定において重要なのか」をお読みください。
RCTとリアルワールドエビデンスの違いや、リアルワールドエビデンスが臨床試験の結果をどのように裏付けるのかについて確認するには、以下の「有効性(Efficacy) vs 有⽤性(Effectiveness)」をクリックし、「有効性(Efficacy) vs. 有⽤性(Effectiveness):リアルワールドにおける治療の実現可能性と有⽤性(Effectiveness)に影響する因子」をお読みください。
リアルワールドエビデンス及びリアルワールドデータの情報源の長所及び短所についてより深く知りたい方は、以下の「長所と短所」をクリックし、「長所と短所:リアルワールドエビデンスのデータソースを確認する」をお読みください。
リアルワールドエビデンスとは何か、
なぜ臨床の意思決定において重要なのか?
リアルワールドエビデンスは、リアルワールドデータの解析から得られた、医薬品の使用や潜在的なベネフィット/リスクに関する臨床的なエビデンスです1‒4。
リアルワールドデータは、患者さんの健康、治療効果、安全性、医療の提供に関するもので、様々な情報源や試験デザインから日常的に収集されます1‒4。
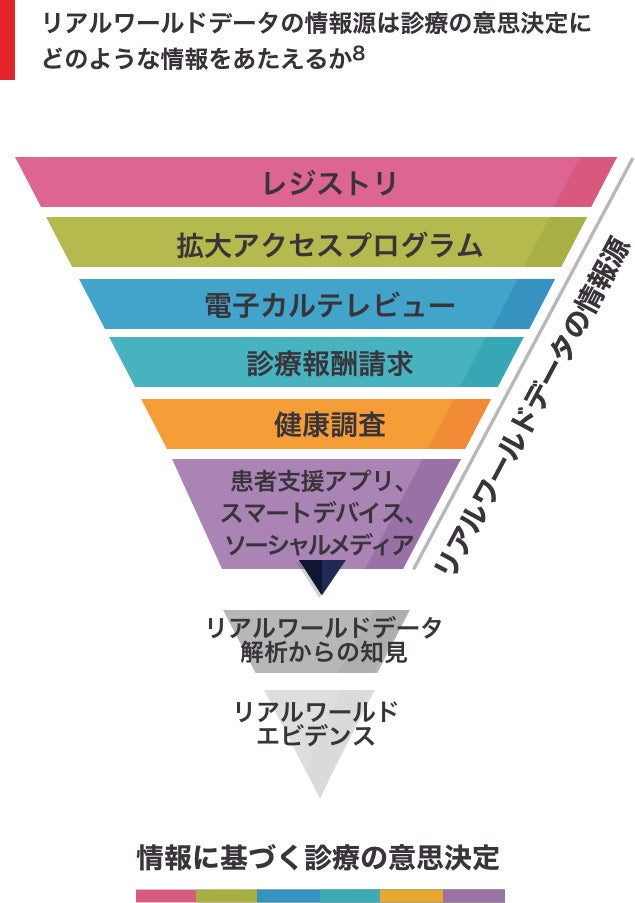
リアルワールドエビデンスは、無作為化比較試験(以下、RCT)以外の場で、観察(非介入)研究を通じて標準的な診療の中で発生するものであり1,3、データソースとしては、以下が挙げられます1‒4。
- 地域/国の臨床レジストリ
- 電子カルテや電子健康記録
- 診療報酬請求データベース
リアルワールドエビデンスは、リアルワールドにおいて進化していく診療及び治療アウトカムを理解する上で重要です5。
これは、既承認の治療選択肢が急速に広がっており、治療がますます複雑化している多発性骨髄腫の治療においては、特に重要と言えます2。
近年、多発性骨髄腫の治療の有効性(Efficacy)の著しい改善がRCTにおいて実証されており、これらの改善が実際の診療にどのように反映されるかを判断する上で、リアルワールドエビデンスはますます重要になっています6。
また、リアルワールドエビデンスは実際の臨床で行われる治療上の配慮を把握する上でも重要です。
RCTでは必ずしも十分に検討されていない事項には、患者さんの不均一性だけでなく、治療の忍容性や利便性も含まれます5。
厳しい組み入れ基準など様々な理由から、臨床試験は治療に関連するすべての疑問や患者さんのシナリオに答える形で実施できないことが多くあります。
よって、リアルワールドエビデンスは、RCTから得られる情報を補足する役割を有し、多発性骨髄腫患者さんの最適な治療選択を検討する際に、より完全な全体像を把握するためにRCTを補完する重要なツールとなりえます7。
有効性(Efficacy) vs 有⽤性(effectiveness):
リアルワールドにおける治療の実現可能性と
有⽤性(Effectiveness)に影響する因子
無作為化比較試験(以下、RCT)は、医薬品評価のゴールドスタンダードであり、新しい治療法の有効性(Efficacy)及び安全性を評価します。
しかし、RCTには厳格な選択基準及び除外基準があるため、日々の診療で治療する患者集団は、RCTの被験者である患者集団とは多少異なる可能性があります。
RCTは、コントロールされた状況下において介入の成果を評価することにより、「薬が効き得るかどうか」、すなわち、有効性(Efficacy)を調べます1‒3。 この情報は、その治療が選択した患者集団に対して効くことを裏付ける確かなエビデンスとなります。
RCTは、治療に関連しない因子から独立した治療効果を特定する能力を最大限に発揮します2,3。
RCTで得られたデータは、薬事承認、並びに、医師やその他の医療従事者のためのエビデンスに基づくガイドライン作成のために重要です2,3。
リアルワールドエビデンスは、観察研究を通じて、リアルワールドの条件下における介入の成果を評価することにより、「薬が効くかどうか」、すなわち、有⽤性(effectiveness)を調べます1‒3。 包括的なリアルワールド/観察研究は、様々な臨床現場で治療を受ける不均一な患者集団における、日常診療での介入の潜在的なリスクとベネフィットを示すことができます2。 観察研究によるデータに対しては、規制当局のみならず、医療費支払者及び医療技術評価当局の関心もますます高まっています。また、それらのデータは、医師やその他の医療従事者に対して患者管理に関する実用的な情報をもたらすことができます1,2,9。
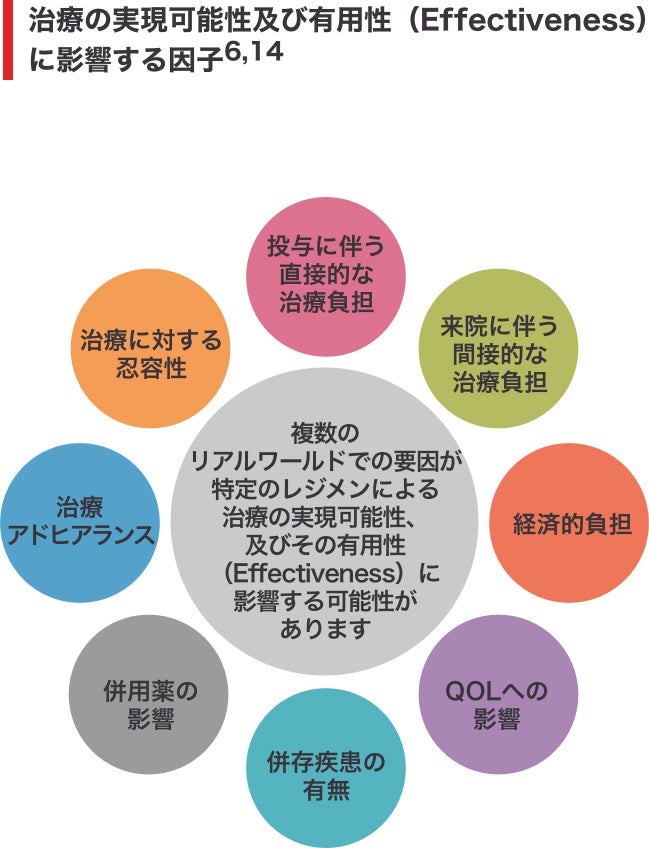
RCTにおいて一般的に被験者集団に占める割合が少ない患者さんとして、高齢者又はフレイル(frail)患者さん、併存疾患を有する患者さん、社会経済的立場が低い患者さん、民族的又は人種的マイノリティが挙げられます10‒13。 これらの特性は、RCTに反映されている特性と比較して、より劣る転帰に関連してきました10‒13。多発性骨髄腫では、高齢、機能低下及び併存疾患は、死亡や毒性リスクの予測因子となる”フレイル(frail)”の構成要素となっています6。
また、RCTの厳格な実施計画書は、被験者らが非常に類似した、コントロールされた条件下で管理されることを意味し、治験実施計画書に規定される用量変更等の因子は、より良い忍容性や、より長い治療期間につながる可能性があります6。 リアルワールド環境下では、患者さんと医師では優先することや動機が一致しない可能性があり、移動能力、病院からの距離、治療中に必要な来院回数、医療アクセスの問題、及び直接的/間接的費用等の因子が、治療の早期中止の一因になる可能性があります6。
こういった点を考慮すると、リアルワールドでの解析から得られるデータの解釈は非常に複雑なものとなります。 それでも、リアルワールドエビデンスはより幅広い多発性骨髄腫患者集団の治療に関して、更なるインサイトを得るのに役立ちます。
長所と短所:
リアルワールドエビデンスのデータソースを確認する
リアルワールド研究の有⽤性(Effectiveness)は、無作為化比較試験(以下、RCT)のデータを補完し、臨床的知識により広いインサイトを提供する点にあります。
図1:リアルワールドエビデンスの長所5,7,14
リアルワールド研究の方法の厳格さが改善され、質の高い大規模なデータセットが利用可能になるにつれて、リアルワールドエビデンスから得られる知見の重要性が高まっています7。


図2:リアルワールドエビデンスの短所6,7,17
ただし、リアルワールドエビデンスの短所を見落とさないことも重要です。 リアルワールドでのデータ収集は、標準化されていない場合が多く、特にデータプライバシーに関する懸念の高まりに伴い、患者データへのアクセスは困難なことがあります15。

加えて、毒性はプロスペクティブかつ明確に研究されたときに最も記述されるため、多くのレトロスペクティブなリアルワールドエビデンス論文は完全な安全性情報を示すことができない可能性があります16。
治療と安全上の懸念との因果関係の立証は、プロスペクティブ臨床試験と比較してより困難な可能性があります16。
そのような短所はあるものの、リアルワールドエビデンスは、当初の臨床試験では解析又は組入れされなかった患者サブグループの管理方法についての理解を深めるのに役立ちます。

加えて、毒性はプロスペクティブかつ明確に研究されたときに最も記述されるため、多くのレトロスペクティブなリアルワールドエビデンス論文は完全な安全性情報を示すことができない可能性があります16。
治療と安全上の懸念との因果関係の立証は、プロスペクティブ臨床試験と比較してより困難な可能性があります16。
そのような短所はあるものの、リアルワールドエビデンスは、当初の臨床試験では解析又は組入れされなかった患者サブグループの管理方法についての理解を深めるのに役立ちます。
1. Berger, M. L. et al. Pharmacoepidemiol. Drug Saf. 2017; 26: 1033-1039. 2. Garrison, L. P., Neumann, P. J., Erickson, P., Marshall, D. & Mullins, C. D. Value Health J. Int. Soc. Pharmacoeconomics Outcomes Res. 2007; 10: 326–335. 3. Makady, A. et al. Value Health J. Int. Soc. Pharmacoeconomics Outcomes Res. 2017; 20: 858-865. 4. Breckenridge, A. M., Breckenridge, R. A. & Peck, C. C. R Br. J. Clin. Pharmacol. 2019; 85: 1874-1877. 5. Costello, C. et al. Future Oncol. 2019; 15: 1411-1428. 6. Richardson, P. G. et al. Blood Cancer J. 2018; 8: 109. 7. Blonde, L., Khunti, K., Harris, S. B., Meizinger, C. & Skolnik, N. S. Adv. Ther. 2018; 35: 1763-1774. 8. FDA. FRAMEWORK FOR FDA’S REAL-WORLD EVIDENCE PROGRAM. Available at: https://www.fda.gov/media/120060/download. Last accessed August 2021. 9. Makady, A. et al. Value Health J. Int. Soc. Pharmacoeconomics Outcomes Res. 2017; 20: 520-532. 10. Shah, J. J. et al. Clin. Lymphoma Myeloma Leuk. 2017; 17: 575-583.e2. 11. Costa, L. J., Hari, P. N. & Kumar, S. K. Leuk. Lymphoma 2016; 57: 2827-2832. 12. Ganguly, S., Mailankody, S. & Ailawadhi, S. Am. Soc. Clin. Oncol. Educ. Book 2019; 519–529: doi:10.1200/EDBK_238551. 13. Pulte, E. D. et al. Blood Adv. 2018; 2: 116–119. 14. Richardson, P. G. et al. Blood 2017; 130: 3149–3149. 15. Rudrapatna, V. A. & Butte, A. J. J. Clin. Invest. 2020: 130: 565–574. 16. Di Maio, M., Perrone, F. & Conte, P. The Oncologist 2020; 25: e746-e752. 17. Kim, H.-S., Lee, S. & Kim, J. H. J. Korean Med. Sci. 2018; 3. 18. Office of the Commissioner. Real-World Evidence. 2020. FDA. Available at: https://www.fda.gov/ science- research/science-and-research-special-topics/real-world-evidence. Last accessed Sept 2021. 19. EMA. Harnessing the potential of real world data through a learning healthcare system'. 2018. Available at: https://www.ema.europa.eu/en/news/ harnessing-potential-real-world-data-through-learning-healthcare-system. 20. Health Canada. Regulatory review of drugs and devices: Strengthening the use of real world evidence for drugs. 2018. Available at: https://www.canada.ca/ en/health-canada/ corporate/transparency/regulatory-transparency-and-openness/improving-review-drugs-devices/strengthening-use-real-worldevidence- drugs.html 21. Eichler, H.-G. et al. Clin. Pharmacol. Ther. 2019; 105: 912–922.
略語
EHR/EMR:電⼦健康記録/電⼦カルテ、EMA:欧州医薬品庁、EU:欧州連合、FDA:⽶国⾷品医薬品局、HCP:医療従事者、MM:多発性⾻髄腫、OECD:経済協⼒開発機構、RCT:無作為化⽐較試験、RRMM:再発難治性多発性⾻髄腫
5. 本研究はTakeda Pharmaceutical company limited.の資金により行われた。本論文の著者のうち2名は、Takeda Pharmaceutical company limited.の社員である。本研究のメディカルライティングにおいてTakeda Pharmaceutical company limited.の支援を受けた。著者にTakeda Pharmaceutical company limited.より講演料、コンサルタント料等を受領している者が含まれる。6. 本研究はTakeda Pharmaceutical company limited.の資金により行われた。本論文の著者のうち3名は、Takeda Pharmaceutical company limited.の社員、1名は元社員である。本研究のメディカルライティングにおいてTakeda Pharmaceutical company limited.の支援を受けた。著者にTakeda Pharmaceutical company limited.より講演料、コンサルタント料等を受領している者が含まれる。10. 著者にTakeda Pharmaceutical company limited.より講演料、コンサルタント料等を受領している者が含まれる。14. 著者にTakeda Pharmaceutical company limited.より講演料、コンサルタント料等を受領している者が含まれる。16. 著者にTakeda Pharmaceutical company limited.より講演料、コンサルタント料等を受領している者が含まれる。